Endometrioza to przewlekła choroba ginekologiczna, która charakteryzuje się obecnością ektopowego endometrium rozwijającego się poza jamą macicy. W tej chorobie ektopowe (nieprawidłowo położone) endometrium znajduje się głównie w jajnikach, ale może rozprzestrzeniać się również na otrzewną miednicy, więzadła maciczno-krzyżowe, jajowody, więzadła szerokie oraz jelita.
Szacuje się, że endometrioza może dotyczyć nawet 10–15% kobiet w wieku rozrodczym, przy czym częstość jej występowania jest wyraźnie większa wśród kobiet niepłodnych (25–50%). Warto również zauważyć, że u 30–50% pacjentek z tą chorobą występują trudności z zajściem w ciążę.
Spis treści:
- Etiopatogeneza – przyczyny endometriozy
- Endometrioza a mikrobiota. Czy dysbioza ma wpływ na rozwój endometriozy?
- Rola estrobolomu w rozwoju endometriozy
- Mikrobiota jelitowa w endometriozie
- Endometrioza – objawy jelitowe
- Endometrioza jelit – trudności diagnostyczne
- Objawy żołądkowo-jelitowe w endometriozie
- Endometrioza jelit – leczenie
- Podsumowanie
Etiopatogeneza – przyczyny endometriozy
Endometrioza pod względem rozwoju należy do chorób wieloczynnikowych, a jej etiopatogeneza nie jest do końca poznana. Teorią wyjaśniającą pochodzenie ektopowej tkanki endometrialnej, która zyskała dość szeroką akceptację, jest koncepcja „miesiączki wstecznej”.
Zakłada ona cofanie się resztek menstruacyjnych wraz z żywymi komórkami endometrium przez jajowody do jamy miednicy. Tak przemieszczone komórki endometrium muszą przylgnąć do powierzchni otrzewnej (zjawisko adhezji), a następnie namnożyć się, aby przekształcić się w zmiany inwazyjne.
Komórki endometrium u kobiet cierpiących na endometriozę wykazują zwiększone właściwości adhezyjne w wyniku dwóch mechanizmów:
- Zmienionego profilu specyficznych białek zwanych integrynami, które są odpowiedzialne za przyleganie komórek.
- Adhezja komórkowa jest dodatkowo zwiększona przez zmienione zapalnie środowisko otrzewnej, które jest postrzegane jako cecha charakterystyczna endometriozy. Ogromną rolę odgrywa tu działanie prozapalnej cytokiny interleukiny-8, która moduluje początkowe stadium choroby.
>> Więcej w artykule: Endometrioza – życie z chorobą
Endometrioza a mikrobiota. Czy dysbioza ma wpływ na rozwój endometriozy?
Rozwój ognisk endometriozy uzależniony jest również od pewnej dysfunkcji układu odpornościowego. U pacjentek z endometriozą obserwuje się różnice w inicjacji i intensywności odpowiedzi immunologicznej.
Wykazano, że głównym czynnikiem regulującym te procesy jest mikrobiota jelitowa. Obecność określonych bakterii w jelitach wstępnie stymuluje neutrofile i przygotowuje je do mobilizacji w ogniskach zapalnych w otrzewnej. Dodatkowo, dysbioza jelitowa upośledza funkcję barierową, powodując zwiększoną przepuszczalność jelit, co może dodatkowo intensyfikować zapalenie.
Finalnie wzrasta liczba makrofagów w otrzewnej, ale nie są one pełnowartościowe, gdyż ich zdolność do fagocytozy nowo wszczepionych zmian endometrialnych jest ograniczona, co ułatwia przeżycie takich wszczepów.
Zaburzenia immunologiczne powodowane dysbiozą przewodu pokarmowego stanowią czynnik stymulujący przewlekły stan zapalny, który jest ściśle związany z endometriozą. To z kolei stwarza środowisko sprzyjające neoangiogenezie (tworzeniu nowych naczyń krwionośnych), włóknieniu i zrostom, czyli krytycznym cechom tej choroby.
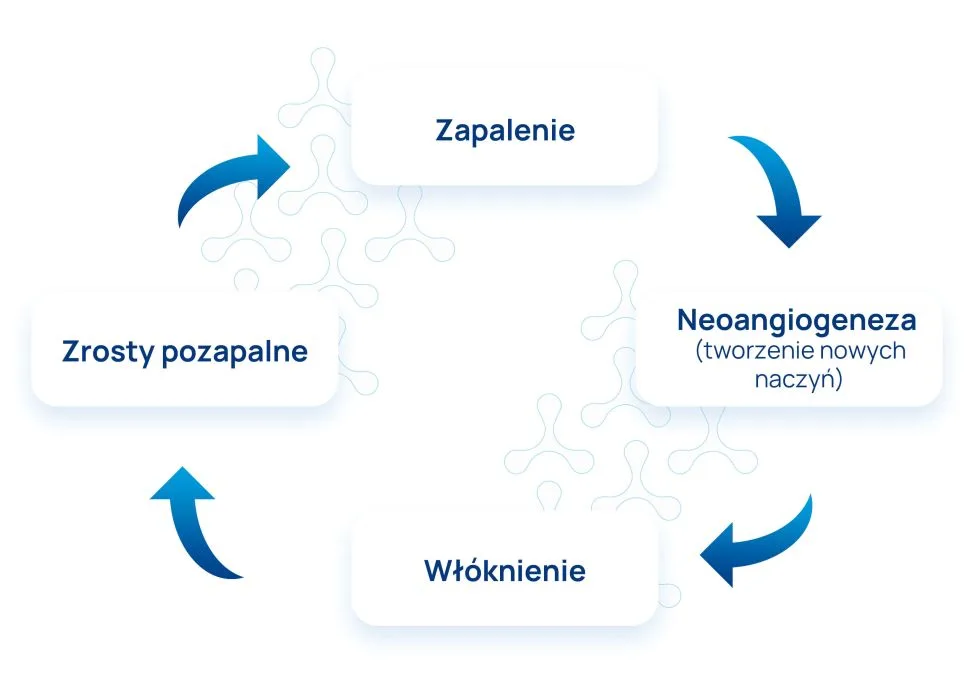
Obecnie powszechnie akceptowana jest teza, że wysokie stężenie miejscowe cytokin powodujące odczyn zapalny w otrzewnej jest cechą charakterystyczną endometriozy. Samo zjawisko wysokich stężeń cytokin może mieć również swoje implikacje w funkcjonowaniu przewodu pokarmowego, np. hamowaniu perystaltyki jelit i wydzielania kwasu solnego w żołądku.
Takie warunki są mniej sprzyjające dla gatunków Lactobacilli i pozwalają na rozrost bakterii Gram-ujemnych, co wykazano na modelu zwierzęcym.
Rola estrobolomu w rozwoju endometriozy
Innym zjawiskiem wiążącym mikrobiotę jelitową z endometriozą jest regulacja puli ogólnoustrojowego estrogenu. Wiadomo, że część bakterii jelitowych wykazuje aktywność enzymu β-glukuronidazy. Enzym ten przekształca estrogeny w ich aktywne formy, dzięki czemu mogą one ponownie wiązać się z receptorem estrogenowym.
Zbiór genów kodujących enzymy metabolizujące estrogeny w mikrobiocie jelitowej jest powszechnie znany jako „Estrobolom”. W przypadku dysbiozy jelitowej może dochodzić do zwiększonego wydzielania β-glukuronidazy przez drobnoustroje, co niesie ze sobą zwiększenie ogólnej puli estrogenów.
Aktywny estrogen w jelitach może być następnie transportowany naczyniami krwionośnymi do różnych tkanek organizmu. Obecnie podejrzewa się, że mikrobiota jelitowa pacjentek z endometriozą wykazuje większą liczebność bakterii wytwarzających β-glukuronidazę.
>> Dowiedz się więcej: Mikrobiota jelitowa – estrobolom i zaburzenia hormonalne u kobiet
Mikrobiota jelitowa w endometriozie
Analiza genomu drobnoustrojów ujawniła, że kilka rodzajów bakterii wchodzących w skład mikrobioty jelitowej, w tym Bacteroides, Bifidobacterium, Escherichia coli i Lactobacillus, może wytwarzać β-glukuronidazę.
Co ciekawe, badania wykazały znaczny wzrost liczebności Escherichia coli w stolcu pacjentek z endometriozą. Odkrycia te sugerują, że mikrobiota jelitowa może przyczyniać się do podwyższonego stężenia estrogenów, tworząc środowisko sprzyjające postępowi endometriozy.
Dodatkowo konsekwencje związane z dysbiozą i zaburzonym stosunkiem Firmicutes/Bacteroidetes mogą również skutkować rozregulowaniem metabolizmu estrogenów, ponieważ drobnoustroje w tych gromadach posiadają geny związane z glukuronidazą. Do najliczniejszych typów bakterii w stolcu pacjentek z endometriozą zaliczają się Firmicutes, Bacteroidetes i Proteobacteria, wszystkie z częstością występowania >90%.
Analizując liczebność poszczególnych rodzajów bakterii w stolcu pacjentek chorujących na endometriozę, wykazano, że rodzaje Sneathia, Barnesiella i Gardnerella były znacząco zmniejszone.
Analiza konkretnych taksonów wykazała, że liczebność Clostridia Clostridiales, Lachnospiraceae Ruminococcus, Clostridiales Lachnospiraceae i Ruminococcaceae Ruminococcus była znacząco niższa, podczas gdy Eggerthella lenta i Eubacterium dolichum wykazywały podwyższoną liczebność w stolcu pacjentek z endometriozą w porównaniu z grupą kontrolną.
Badania przeprowadzone przez Svenssona i wsp. wykazały, że mikrobiota jelitowa pacjentek z endometriozą wykazywała mniejsze zróżnicowanie w porównaniu z kobietami zdrowymi z grupy kontrolnej.
Endometrioza – objawy jelitowe
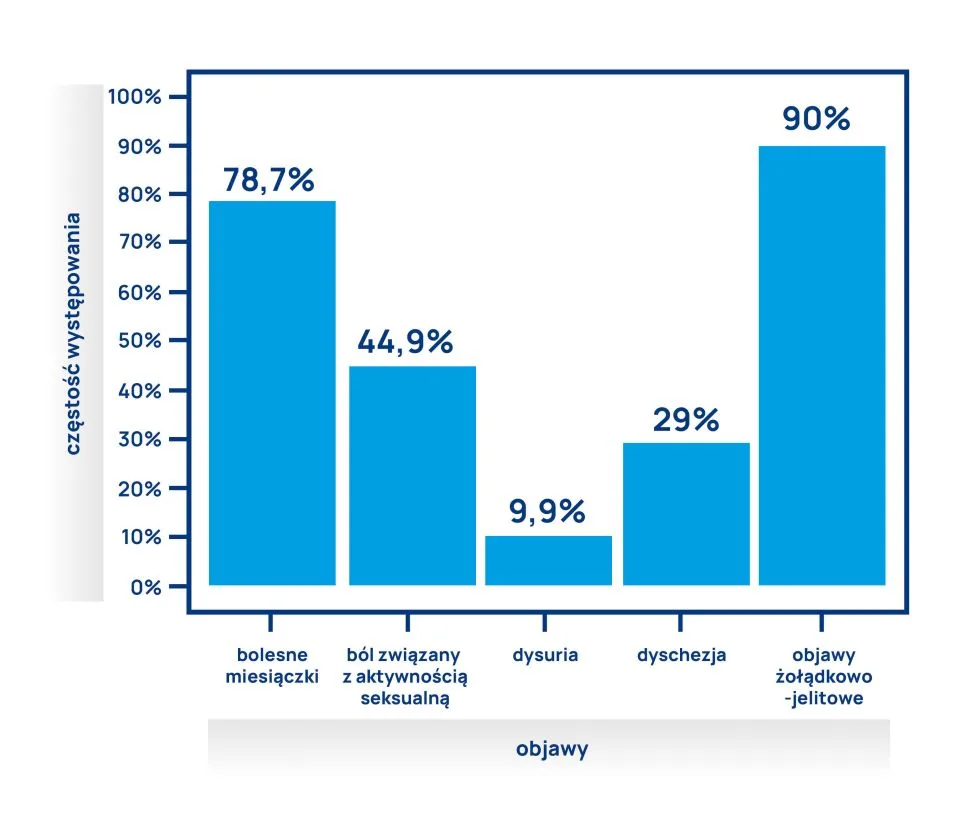
Wśród kobiet z histologicznie potwierdzoną endometriozą aż 90% zgłaszało objawy ze strony przewodu pokarmowego. Najczęściej zgłaszanym objawem były wzdęcia, które dotyczyły 83% chorych. Co ciekawe, tylko niewielki odsetek kobiet z objawami żołądkowo-jelitowymi miał endometriozę jelit. To dowodzi, że objawy gastroenterologiczne w endometriozie nie zależą wyłącznie od nacieku endometrialnego jelit.
Częstość występowania endometriozy jelit wynosi 3-37% wszystkich kobiet dotkniętych tą chorobą. Najczęstszą lokalizacją jest:
- odbytnica i esica (70-93%),
- okolica krętniczo-kątnicza,
- wyrostek robaczkowy,
- inne odcinki okrężnicy i jelita cienkiego.
Endometrioza jelit zwykle jest bezobjawowa. Często zostaje rozpoznana dopiero po zabiegach operacyjnych wykonanych z innych wskazań. Objawy, jeżeli występują, często są niespecyficzne. Niemniej należy pamiętać, że czasem naciek endometrialny na jelita może być powodem ostrych bólów brzucha, których przyczyną jest niedrożność przewodu pokarmowego.
Endometrioza jelit – trudności diagnostyczne
Współwystępowanie objawów żołądkowo-jelitowych u pacjentek chorych na endometriozę, nawet bez zajęcia jelit, ma swoje implikacje w dwóch obszarach. Po pierwsze, zwiększa ryzyko błędnej diagnozy lub zjawiska nakładania się chorób, takich jak zespół jelita nadwrażliwego (IBS) lub nieswoistej choroby zapalnej jelit (IBD). Po drugie, jest to pośredni dowód współistniejących w endometriozie zaburzeń mikrobioty jelitowej, których głównym objawem mogą być właśnie wzdęcia.

Objawy żołądkowo-jelitowe w endometriozie
Warto zwrócić uwagę na inne, poza wzdęciami, objawy żołądkowo-jelitowe, które często zgłaszają kobiety z endometriozą. Należą do nich:
- zaparcia,
- nudności,
- wymioty,
- biegunka.
Należy podkreślić, że u większości pacjentek przed ostatecznym rozpoznaniem wyżej wymienione objawy żołądkowo-jelitowe trwają długo (powyżej 5 lat). Pacjentki te, w 21% przypadków, były wcześniej diagnozowane i leczone w kierunku zespołu jelita nadwrażliwego.
Endometrioza jelit – leczenie
Czy leczenie endometriozy poprzez zabieg laparoskopowy zmniejsza objawy gastroenterologiczne? Przeprowadzone badania zdają się potwierdzać tę tezę. Istotną poprawę w zakresie objawów żołądkowo-jelitowych zgłosiło 72,6% chorych po sześciu miesiącach i 52,1% po 12 miesiącach od zabiegu.
Podsumowanie
Endometrioza jest częstą chorobą ginekologiczną, której objawy – nie zawsze specyficzne i zazwyczaj obejmujące przewód pokarmowy – powodują, że rozpoznanie i leczenie bywa opóźnione. Przedstawione powyżej argumenty przemawiają za istnieniem interakcji pomiędzy endometriozą a dysbiozą jelitową, a poznanie tych zależności może przyczynić się do poprawy diagnostyki i leczenia tej choroby.
Piśmiennictwo
1. Zizolfi B, Foreste V, Gallo A, i wsp. Endometriosis and dysbiosis: State of art. Front Endocrinol (Lausanne). 2023 Feb 20;14:1140774.
2. Practice Committee of the American Society for Reproductive Medicine . Endometriosis and infertility. Fertil Steril (2004) 81(5):1441–6.
3. Machairiotis N, Stylianaki A, Dryllis G, i wsp. Extrapelvic endometriosis: A rare entity or an under diagnosed condition? Diagn Pathol (2013) 8(1):194.
4. Yovich J.L., Rowlands P.K., Lingham S., Sillender M., Srinivasan S. Pathogenesis of Endometriosis: Look No Further than John Sampson. Reprod. Biomed. Online. 2020;40:7–11.
5.Halme J., Hammond M.G., Hulka J.F., Ri wsp. Retrograde Menstruation in Healthy Women and in Patients with Endometriosis. Obstet. Gynecol. 1984;64:151–154
6. Klemmt P.A.B., Carver J.G., Koninckx P. i wsp. Endometrial Cells from Women with Endometriosis Have Increased Adhesion and Proliferative Capacity in Response to Extracellular Matrix Components: Towards a Mechanistic Model for Endometriosis Progression. Hum. Reprod. 2007;22:3139–3147.
7. Garcia-Velasco J.A., Arici A. P-255. Interleukin-8 Stimulates Endometrial Stromal Cell Adhesion to Fibronectin. Hum. Reprod. 1999;14:268.
8. Laschke M.W., Menger M.D. The Gut Microbiota: A Puppet Master in the Pathogenesis of Endometriosis? Am. J. Obstet. Gynecol. 2016;215:68.e1–68.e4.
9. Bailey M.T., Coe C.L. Endometriosis Is Associated with an Altered Profile of Intestinal Microflora in Female Rhesus Monkeys. Hum. Reprod. 2002;17:1704–1708.
10. Ervin SM, L i H, Lim L, i wspGut microbial β-GlucuronidasesReactivate estrogens as components of the estrobolome that reactivate estrogens. J Biol Chem (2019) 294:18586–99.
11. Baker JM, Al-Nakkash L, Herbst-Kralovetz MM. Estrogen–gut microbiome axis: Physiological and clinical implications. Maturitas (2017) 103:45–53.
12. Huang L, Liu B, Liu Z, i wsp.. Gut Microbiota Exceeds Cervical Microbiota for Early Diagnosis of Endometriosis. Front Cell Infect Microbiol. 2021 Dec 7;11:788836.
13. Svensson A., Brunkwall L., Roth B., i wsp. Associations between endometriosis and gut microbiota. Reprod. Sci. 2021;28:2367–2377.
14. Greene R., Stratton P., Cleary S.D., i wsp. Diagnostic experience among 4,334 women reporting surgically diagnosed endometriosis. Fertil. Steril. 2009;91:32–39.
15. Hu S., Ding Q., Zhang W. i wsp. Gut microbial beta-glucuronidase: A vital regulator in female estrogen metabolism. Gut Microbes. 2023;15:2236749.
16. Maroun P., Cooper M.J.W., Reid G.D., i wsp. Relevance of gastrointestinal symptoms in endometriosis. Aust. N. Z. J. Obstet. Gynaecol. 2009;49:411–414.
17. Paixão-Barradas F.P., Sousa V., Pereira D., i wsp. Endometriosis and Crohn’s Disease Side by Side: A Case Report. J. Endometr. Pelvic Pain Disord. 2016;8:24–27.
18. . Viganò D., Zara F., Usai P. i wsp. Irritable bowel syndrome and endometriosis: New insights for old diseases. Dig. Liver Dis. 2018;50:213–219.
19. Xholli A, Cremonini F, Perugi I, i wsp. Gut Microbiota and Endometriosis: Exploring the Relationship and Therapeutic Implications. Pharmaceuticals (Basel). 2023 Dec 7;16(12):1696.
20. Sánchez Cifuentes Á, Candel Arenas MF, Albarracín Marín-Blázquez A. Intestinal endometriosis. Our experience. Rev Esp Enferm Dig. 2016 Aug;108(8):524-5.