Dermatozy, czyli choroby skóry, to coraz częstszy problem, szczególnie w krajach wysoko uprzemysłowionych. Przyczyn tego zjawiska upatruje się między innymi w zachodzących pod wpływem różnych czynników zmian w mikrobiocie jelitowej. Drobnoustroje zamieszkujące jelito człowieka mogą poprzez regulację odpowiedzi odpornościowej modulować przebieg schorzeń o podłożu autoimmunologicznym (np. łuszczycy). Dodatkowo dysbioza jelitowa, czyli zaburzenia ilości, składu i funkcji mikrobioty nasila zjawisko translokacji przez nabłonek śluzówki jelita. Konsekwencją tego zjawiska jest obecność we krwi DNA i bakteryjnych metabolitów pochodzenia jelitowego, które oddziałują na keratynocyty i limfocyty T skóry.
Mikrobiota jelitowa a atopowe zapalenie skóry (AZS)
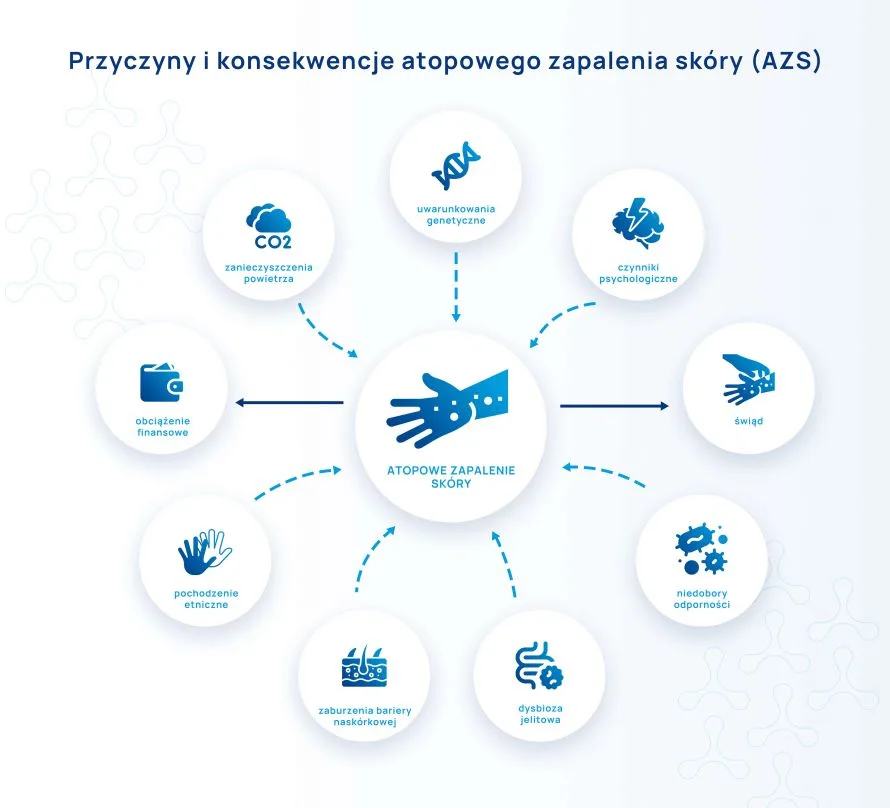
Mikrobiom jelitowy wpływa nie tylko na przebieg, ale i na ryzyko wystąpienia konkretnych chorób skóry (Ryc. 1). Badania przeprowadzone przez Nutten wykazały, że ochronne działanie w stosunku do ryzyka wystąpienia atopowego zapalenia skóry (AZS) ma zróżnicowanie mikrobioty jelitowej. Dodatkowo czynnikiem ochronnym okazało się brak stosowania antybiotyków w pierwszym roku życia, zamieszkiwanie na wsi i uczęszczanie do żłobka. Powyższe czynniki niewątpliwie wpływają na profil tworzącego się mikrobiomu jelitowego, dlatego w badaniach porównujących mikrobiotę jelitową dzieci zdrowych oraz tych, u których w ciągu pierwszych dwóch lat życia wystąpiły objawy AZS, wykazano istotne różnice. Jak wykazały badanie przeprowadzone przez Björkstén i wsp. dzieci z rozpoznaną atopią wykazywały zwiększoną liczebność Staphylococcus aureus przy jednocześnie zredukowanej liczebności Bifidobacterium i Bacteroides w porównaniu z populacją dzieci zdrowych.
Udowodniono również, że stosowanie odpowiednich szczepów probiotycznych (Escherichia coli DSM 17252 i Enterococcus faecalis DSM 16440) u dzieci z obciążeniem rodzinnym w kierunku atopii może zmniejszać ryzyko wystąpienia AZS.
Podobnie badane były różne szczepy bakterii probiotycznych; Lactobacillus rhamnosus, Lactobacillus acidophilus, Lactobacillus plantarum. Okazało się, że mogą one wykazywać skuteczność w zakresie zapobiegania wystąpienia objawów AZS, jak i zmniejszenia nasilenia objawów tej choroby.
Mikrobiota jelitowa a trądzik
Kolejną dermatozą, w której mikrobiota jelitowa ma wpływ na przebieg choroby, jest trądzik pospolity. Jak pokazały badania, nawet 54% pacjentów z trądzikiem może wykazywać cechy dysbiozy jelitowej. Badania mikrobiomu przewodu pokarmowego pacjentów z trądzikiem wykazały:
- zmniejszoną różnorodność,
- zwiększony stosunek Bacteroidetes do Firmicutes,
- zwiększoną liczebnością Proteobacteria i zmniejszoną Actinobacteria phyla.
Dodatkowo ciekawym zjawiskiem u chorych z trądzikiem jest redukcja rodzajów probiotycznych o udowodnionym działaniu przeciwzapalnym – Lactobacillus i Bifidobacterium.
Jednym z rozpatrywanych mechanizmów wpływu mikrobioty jelitowej na przebieg trądziku jest interakcja ze szlakiem mTOR (tzw. ssaczy cel rapamycyny, ang. mammalian target of rapamycin kinase). Kinaza mTOR bierze udział w procesie wzrostu i różnicowania komórek w skórze i, co wydaje się kluczowe, odpowiada za wytworzenie odpowiedniej bariery naskórkowej. Wzrost ekspresji mTOR obserwowany jest u pacjentów z trądzikiem, zarówno w skórze zmienionej, jak i zdrowej.
Natomiast warto podkreślić, że to płeć determinuje rodzaj dysbiozy jelitowej, a różnice w zmianach dysbiotycznych jelit pomiędzy mężczyznami i kobietami są znaczące.

Interesujących wniosków dostarczyło badanie przeprowadzone przez Fabbrocini i wsp., w którym dorosłym chorym na trądzik podawano szczep Lactobacillus rhamnosus SP1. Okazało się, że taka terapia prowadzona przez 12 tyg. powodowała zmniejszenie nasilenia zmian skórnych.
Mikrobiota jelitowa a łuszczyca
Łuszczyca jest chorobą skóry, której bardzo często towarzyszy dysbioza jelitowa i będąca jej konsekwencją translokacja bakterii i metabolitów jelitowych do krwi. W próbkach krwi pacjentów z aktywną postacią łuszczycy izoluje się DNA bakterii jelitowych oraz ich metabolity, które działają na keratynocyty i limfocyty T skóry. Warto podkreślić, że translokację regulują propioniany, octany i maślany (SCFA), pochodzące z fermentacji jelitowej błonnika pokarmowego. Dobrze poznanym zjawiskiem jest zmniejszenie ryzyka translokacji przez wzrost liczebność bakterii wytwarzające SCFA (butyrogennych).
Ciekawych wniosków dostarczyło badanie przeprowadzone w grupie pacjentów z łuszczycą i podwyższonymi parametrami zapalnymi (TNF-alfa i CRP). Polegało ono na doustnej suplementacji szczepem Bifidobacterium infantis przez 6-8 tyg. Po tym okresie obserwowano obniżenie stężenia białek prozapalnych u chorych na łuszczycę.
Piśmiennictwo:
- Nutten S. Atopic dermatitis: global epidemiology and risk factors. Ann Nutr Metab. 2015; 66(Suppl 1): 8–16,
- Björkstén B., i wsp. The intestinal microflora in allergic Estonian and Swedish 2-year- -old children. Clin Exp Allergy. 1999; 29(3): 342–346,
- Gałęcka M,. i wsp. Znaczenie mikrobioty jelitowej w przebiegu atopowego zapalenia skóry (AZS) — nowoczesne metody profilaktyki i leczenia. Forum Medycyny Rodzinnej 2019, tom 13, nr 5, 195–206
- Lau S., I wsp. Oral application of bacterial lysate in infancy decreases the risk of atopic dermatitis in children with 1 atopic parent in a randomized, placebo-controlled trial. J Allergy Clin Immunol. 2012; 129(4): 1040–1047,
- Fabbrocini G., i wsp. Supplementation with Lactobacillus rhamnosus SP1 normalises skin expression of genes implicated in insulin signalling and improves adult acne. Benef. Microbes. 2016;7:625–630.
- Sánchez-Pellicer P., i wsp. Acne, Microbiome, and Probiotics: The Gut-Skin Axis. Microorganisms. 2022 Jun 27;10(7):1303.
- Xie A., i wsp. Lactobacillus for the treatment and prevention of atopic dermatitis: Clinical and experimental evidence. Front Cell Infect Microbiol. 2023 Feb 16;13:1137275.