Spis treści
- Zespół jelita nadwrażliwego – co zmieniła pandemia COVID-19?
- COVID-19 i co dalej?
- Wpływ wirusa SARS-CoV-2 na mikrobiotę jelitową
- Oś mózg-jelito-mikrobiota
- SIBO i IMO – czy potrafimy diagnozować?
- Rozwój technologii badawczej
- Podsumowanie
Zespół jelita nadwrażliwego (Irritable Bowel Syndrome, IBS) – co zmieniła pandemia COVID-19?
Przed pandemią szacowana częstość występowania zespołu jelita nadwrażliwego (Irritable Bowel Syndrome, IBS) w populacji ogólnej wynosiła średnio około 11%. Niestety liczne czynniki sprzyjające wystąpieniu nowych objawów zespołu jelita nadwrażliwego (IBS) (lęk, stosowane leki, czynniki społeczne) spowodowały, że możemy spodziewać się gwałtownego przyrostu nowych pacjentów z tym schorzeniem. Przeprowadzone badania kliniczne wykazały, że sześciomiesięczna obserwacja pacjentów pozwoliła rozpoznać zespół jelita nadwrażliwego (IBS) u 5,3% pacjentów w grupie 280 osób po przebyciu COVID-19. Jak te dane mogą przełożyć się na naszą rzeczywistość? Porównując to z populacją polską, odsetek rzędu 5% w grupie osób po zarejestrowanym oficjalnie przebyciu COVID-19 oznaczałby wzrost nowych przypadków zespołu jelita nadwrażliwego (IBS) o ponad 300 tys. Około 30% chorych z zespołem jelita nadwrażliwego (IBS) zdecyduje się na konsultację lekarską.
COVID-19 i co dalej?
Jak wykazały przeprowadzone badania, w ostrej fazie infekcji wirusem SARS-CoV-2 różne objawy gastrologiczne mogą występować u od 11.4% do nawet 61.1% pacjentów. Natomiast niepokojące wydają się doniesienie dotyczące konieczności diagnostyki i leczenia objawów post-COVID i long-COVID. Warto podkreślić, że przeprowadzone obserwacje potwierdziły wysoką częstość występowania różnych objawów gastrologicznych (nudności, wymioty, utrata apetytu, ból brzucha, refluks żołądkowo-przełykowy, biegunka) nawet u 44% pacjentów 12 tygodni od zakończenia hospitalizacji z powodu zakażenia wirusem SARS-CoV-2. Ból brzucha jako objaw „post-COVID” może występować nawet w 20% przypadków chorych po przebyciu COVID-19.
Wpływ wirusa SARS-CoV-2 na mikrobiotę jelitową
Jedną z charakterystycznych zmian w mikrobiocie jelitowej u pacjentów w trakcie ostrej fazy infekcji wirusem SARS-CoV-2 jest zmniejszenie liczebności bakterii produkujących krótkołańcuchowe kwasy tłuszczowe (SCFA). Co ciekawe fenomen ten ma charakter przetrwały i obserwowany był nawet po 30 dniach od wyzdrowienia. SCFA to aktywne biometabolity o działaniu przeciwzapalnym. Dodatkowo stanowią kluczowy sygnał w osi mikrobiota-jelito-mózg. Dysfunkcja w zakresie funkcjonowania tej osi nie tylko przyczynia się do neuropsychiatrycznych konsekwencji COVID-19, ale również ma kluczowy wpływ na choroby czynnościowe przewodu pokarmowego.

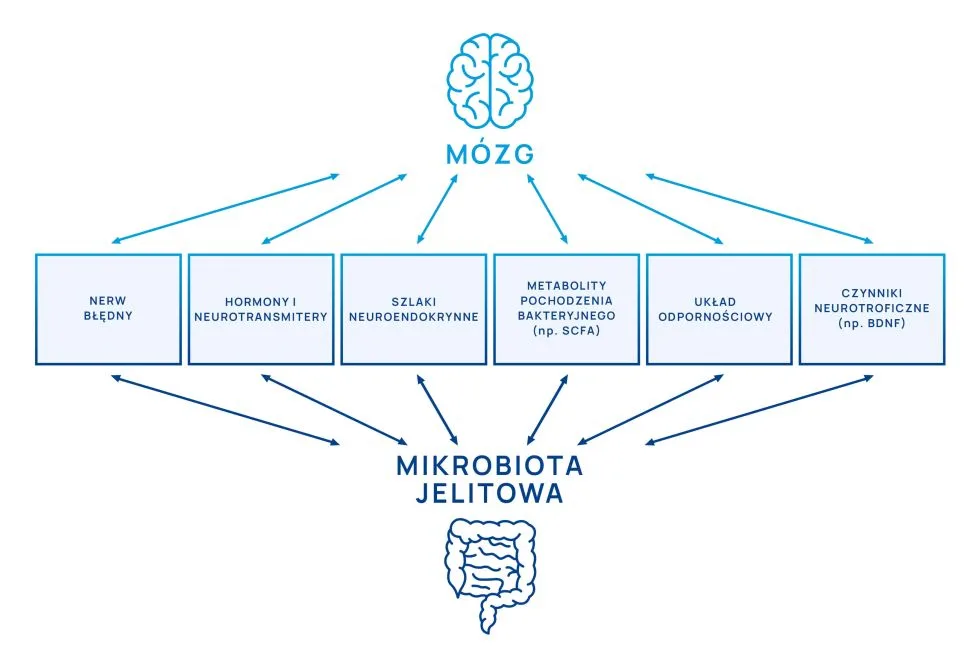
Oś mózg-jelito-mikrobiota
Przesyłanie informacji w ramach osi mózg-jelito-mikrobiota jest dwukierunkowe i wykorzystuje następujące szlaki:
1. Nerw błędny.
2. Hormony i neurotransmitery. Część z nich może bezpośrednio wpływać na nerw błędny i ośrodkowy układ nerwowy (OUN). Natomiast bariera krew-mózg w przypadku neurotransmiterów jest często czynnikiem wręcz uniemożliwiającym bezpośredni ich wpływ na OUN. Natomiast posiadana przez niektóre bakterie zdolność wytwarzania pęcherzyków błonowych, które prawdopodobnie wykazują zdolność pokonywania bariery krew-mózg może tłumaczyć hipotetyczny wpływ zawartych w nich m.in neurotransmiterów na OUN.
3. Szlaki neuroendokrynne: główne znaczenie ma oś podwzgórze-przysadka-nadnercza. Kortyzol wpływa na motorykę przewodu pokarmowego i determinuje skład mikrobioty jelitowej.
4. Szlaki immunologiczne.
5. Metabolity pochodzenia bakteryjnego: zwłaszcza krótkołańcuchowe kwasy tłuszczowe.
6. Czynniki neurotroficzne
Wpływ mikrobioty jelitowej na funkcjonowanie przewodu pokarmowego zachodzi m.in. poprzez:
- produkty metabolizmu, takie jak SCFA,
- lipopolisacharyd (LPS),
- gazy np. wodór, metan lub siarkowodór.
Wyniki testów oddechowych z glukozą lub laktulozą wykazujące podwyższone stężenia wodoru i/lub ocenianego głównie w badaniach klinicznych siarkowodoru w wydychanym powietrzu związane są częściej z postacią biegunkową IBS. Podwyższenie stężenia metanu w omawianym badaniu stanowi obraz bardziej typowy dla chorych z zaparciami.
SIBO i IMO – czy potrafimy diagnozować?
Methanobrevibacter smithii – archeon, który uznawany jest za głównego producenta metanu w przewodzie pokarmowym, może rozrastać poza jelitem cienkim. Ostatnio zaproponowany termin, rozrost metanogenny w jelicie (IMO), jest zatem bardziej odpowiedni. Wyróżnienie spośród zaburzeń dysbiotycznych rozrostu metanogennego w jelicie (IMO) nie tylko podkreśla odrębną specyfikę etiologii tego problemu, ale często wiązany jest z innym spektrum objawów. Wytyczne ACG Clinical Guideline (2020 r.) wymieniają testy oddechowe z glukozą lub laktulozą jako pośrednią metodę diagnozowania zespołu rozrostu bakteryjnego jelita cienkiego (SIBO) i rozrostu metanogennego w jelicie (IMO).

Rozwój technologii badawczej
Spośród różnych metod diagnostyki molekularnej na szczególną uwagę zasługuje technologia analizy różnicy nukleotydów w bakteryjnym genie 16S rRNA. Umożliwia ona identyfikację konkretnych drobnobnoustrojów, których udział w rozwoju dysbiozy został wcześniej udowodniony. Badania, których celem była ocena wykorzystania tej metody w analizie stolca wykazały, że dysbioza stwierdzana była u 73% pacjentów z zespołem jelita nadwrażliwego (IBS) i 74% pacjentów z nieswoistą chorobą zapalną jelit.
Podsumowanie
Zaburzenia dysbiotyczne, które wpływają na interakcję elementów osi mózg-jelito-mikrobiota to ważny aspekt patogenezy gastrologicznych chorób czynnościowych. Szczegółowe poznanie tych zależności pozwoliłoby, przynajmniej w wybranych przypadkach, na określenie celu terapeutycznego. To z kolei mogłoby zwiększać szanse na skuteczną terapię.
Piśmiennictwo:
1. Pietrzak A, Skrzydło-Radomańska B, Mulak A, i wsp. Guidelines on the management of irritable bowel syndrome: In memory of Professor Witold Bartnik. Prz Gastroenterol. 2018;13(4):259-288.
2. Ghoshal UC, Ghoshal U, Rahman MM, I wsp. Post-infection functional gastrointestinal disorders following coronavirus disease-19: A case-control study. J Gastroenterol Hepatol. 2022 Mar;37(3):489-498.
3. Kariyawasam JC, Jayarajah U, Riza R, i wsp. Gastrointestinal manifestations in COVID-19. Trans R Soc Trop Med Hyg. 2021 Dec 2;115(12):1362-1388.
4. Weng J, Li Y, Li J, Shen L, Zhu L, Liang Y, et al. Gastrointestinal sequelae 90 days after discharge for COVID-19. Lancet Gastroenterol Hepatol. 2021;6:344–346.
5. Zhang F, Wan Y, Zuo T, i wsp. Prolonged Impairment of Short-Chain Fatty Acid and L-Isoleucine Biosynthesis in Gut Microbiome in Patients With COVID-19. Gastroenterology. 2022 Feb;162(2):548-561.e4.
6. Du Y, Gao XR, Peng L, i wsp. Crosstalk between the microbiota-gut-brain axis and depression. Heliyon. 2020 Jun 3;6(6):e04097..
7. Pimentel M, Saad RJ, Long MD, I wsp. ACG Clinical Guideline: Small Intestinal Bacterial Overgrowth. Am J Gastroenterol. 2020 Feb;115(2):165-178.
8. Casén C, Vebø HC, Sekelja M I wsp. Deviations in human gut microbiota: a novel diagnostic test for determining dysbiosis in patients with IBS or IBD. Aliment Pharmacol Ther. 2015 Jul;42(1):71-83.

