Spis treści
- Nadnercza – budowa i funkcje
- Zaburzenia czynności nadnerczy
- Niedoczynność kory nadnerczy – przyczyny i diagnostyka
- Nadczynność kory nadnerczy – przyczyny i diagnostyka
Nadnercza – budowa i funkcje
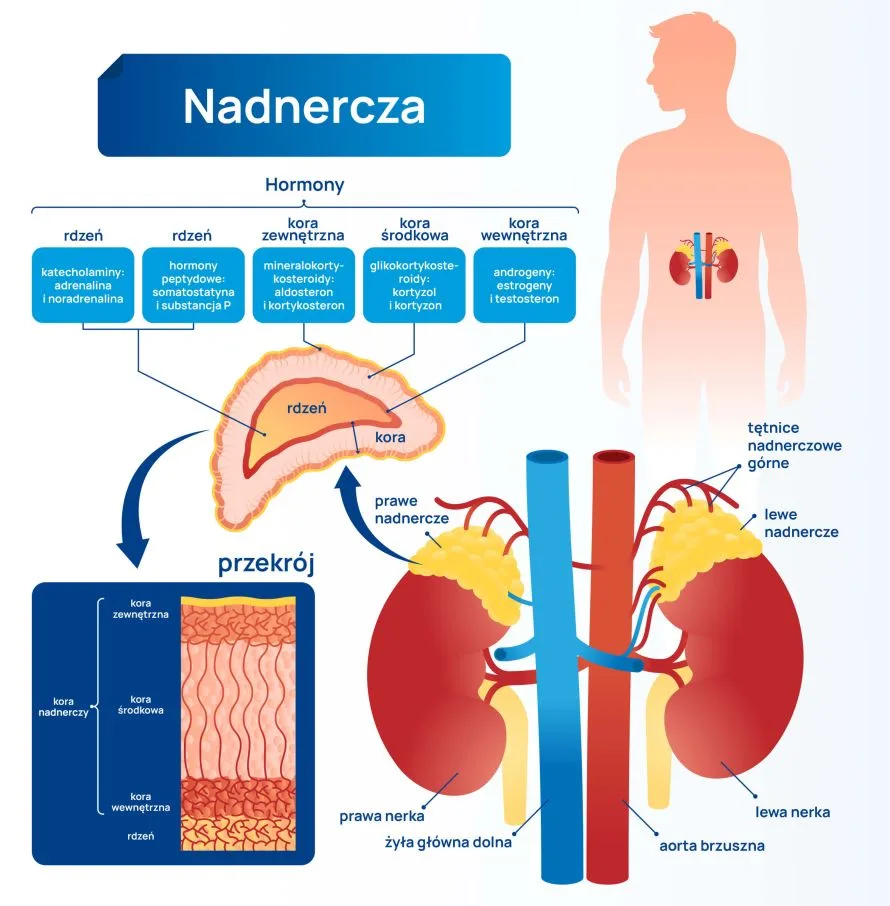
Nadnercza są to dwa symetryczne narządy położone zaotrzewnowo nad górnymi biegunami nerek. Składają się z dwóch warstw: z kory wydzielającej hormony steroidowe i rdzenia, który wydziela katecholaminy.
Nadnercza odgrywają bardzo istotną rolę w organizmie, ponieważ hormony, które wydzielają, umożliwiają reakcję na stres zarówno fizyczny, jak i psychiczny.
Odpowiedź organizmu na zmieniające się warunki środowiska, na sytuacje fizycznego i psychicznego obciążenia zależy w dużej mierze od reakcji hormonalnej osi podwzgórze-przysadka-nadnercza. Mechanizm regulujący wydzielanie tych hormonów jest określany jako podwzgórzowo-przysadkowo-nadnerczowa ujemna pętla sprzężenia zwrotnego.
Wydzielana w podwzgórzu kortykoliberyna (CRH) reguluje wydzielanie kortykotropiny (ACTH) w przednim płacie przysadki (ACTH pozostaje w ujemnym sprzężeniu zwrotnym z CRH). Natomiast kora nadnerczy jest kontrolowana przez przysadkę w odpowiedzi na hormon adrenokortykotropowy (ACTH).
Komórki kory nadnerczy wydzielają trzy główne grupy hormonów, z których każda ma swoje funkcje. Te grupy to:
- Glikokortykosteroidy – produkowane w korze środkowej, warstwie pasmowatej, w odpowiedzi na stres, np. kortyzol.
- Mineralokortykosteroidy – produkowane w korze zewnętrznej, warstwie kłębkowej, regulujące objętość krwi, np. aldosteron.
- Androgeny – produkowane w korze wewnętrznej, warstwie siatkowatej, kontrolujące rozwój płciowy, np. DHEA/DHEA-S, androstendion.
Glikokortykosteroidy
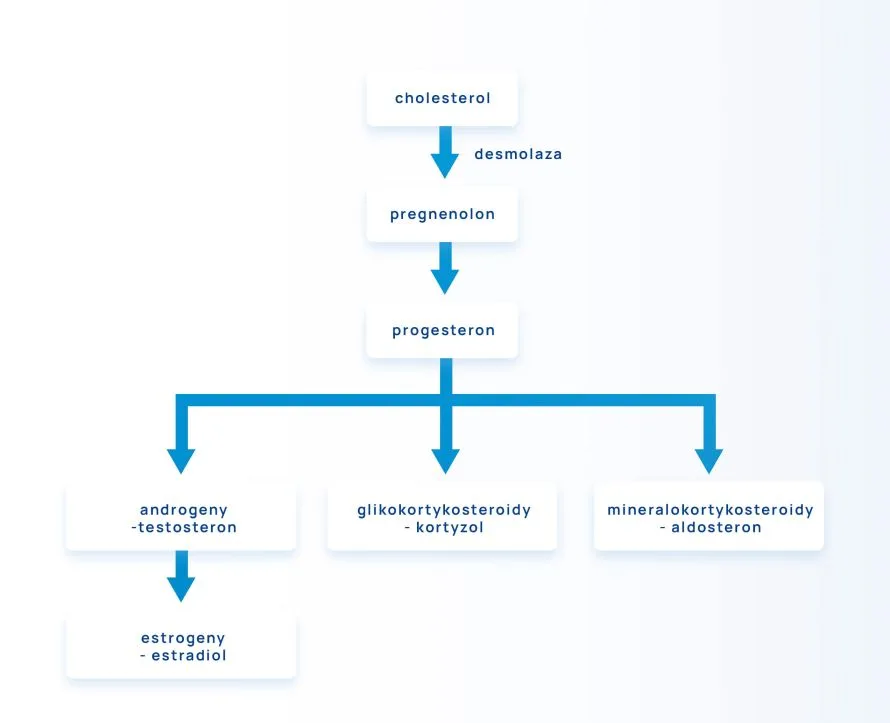
Hormony steroidowe są wytwarzane z cholesterolu poprzez szereg reakcji w mitochondriach oraz gładkiej siateczce endoplazmatycznej. Cholesterol, który jest pozyskiwany z diety lub syntetyzowany w komórkach, przechowywany jest w cytoplazmie komórek syntetyzujących steroidy. Wszystkie steroidy mają tę samą strukturę podstawową utworzoną przez cztery sprzężone pierścienie steranu, natomiast poszczególne hormony różnią się łańcuchami bocznymi pierścieni i wiązaniami w pierścieniach (podwójnymi lub pojedynczymi).

Przekształcenie cholesterolu w hormon steroidowy przebiega dwuetapowo.
Hormony steroidowe są uwalniane bezpośrednio po syntezie.
Mineralokortykosteroidy
Mineralokortykosteroidy pomagają w utrzymaniu jonowej równowagi osocza, są konieczne do utrzymania prawidłowych stężeń sodu i potasu, oraz prawidłowej objętości płynów pozakomórkowych. Zwiększają ciśnienie tętnicze krwi, pobudzając swoiste receptory w ośrodkowym układzie nerwowym. Głównym mineralokortykosteroidem jest aldosteron.

Androgeny
Androgeny nadnerczowe są syntetyzowane w warstwie siatkowatej kory nadnerczy. Głównymi androgenami są androstendion i dehydroepiandrosteron.
Androgeny wydzielane przez nadnercza mają słabe działanie biologiczne, w tkankach obwodowych ulegają konwersji do bardziej aktywnych androgenów, jak testosteron, w czym uczestniczy między innymi aromataza. Początek wydzielania androgenów nadnerczowych ma miejsce przed pełnym dojrzewaniem płciowym, kiedy następuje dojrzewanie warstwy siatkowatej oraz wzrost stężeń DHEA – dehydroepiandrosteronu.
Stężenia DHEA i DHEA-S są ściśle związane z wiekiem. Wzrost ich stężeń następuje od 6.–8. roku życia. Najwyższe stężenia stwierdza się u młodych dorosłych ok. 25. roku życia, a następnie stopniowo one spadają. W 80. roku życia stężenia DHEA i DHEAS stanowią 20% wartości szczytowej.
U dorosłych mężczyzn androgeny nadnerczowe odpowiadają za 5% ogólnej aktywności androgenowej, są więc fizjologicznie nieistotne. U kobiet natomiast stanowią około 50% ogólnej aktywności androgenowej (stymulują rozwój owłosienia łonowego i pachowego).
U kobiet z dehydroepiandrosteronu pochodzi 40–60% obecnego w krążeniu testosteronu; konwersja z DHEA odbywa się w nadnerczach i jajnikach. U mężczyzn z DHEA powstaje 5% puli testosteronu, nie ma to więc znaczenia klinicznego. To, w jakim kierunku metabolizowany jest dehydroepiandrosteron, zależy przede wszystkim od tkanki docelowej i aktywności enzymów katalizujących w niej te przemiany, a nie od płci.
Biologiczne efekty działania DHEA to: poprawa libido i potencji oraz działanie antydepresyjne, pobudzenie kościotworzenia i hamowanie resorpcji tkanki kostnej oraz pobudzenie syntezy kolagenu w skórze i białek w miocytach, poprawa insulinowrażliwości, obniżenie stężenia cholesterolu i hamowanie kumulacji lipidów w błonie wewnętrznej naczyń, działanie naczyniorozszerzające oraz modulacja odpowiedzi immunologicznej – zwiększenie liczby komórek NK, zmiana aktywności limfocytów T-helper.
Główne wskazania do oznaczenia:
- diagnostyka zespołów hiperandrogenizacji,
- diagnostyka niedoczynności kory nadnerczy.
Katecholaminy
W rdzeniu nadnerczy wytwarzane są adrenalina i noradrenalina, a także w niewielkiej ilości dopamina, które należą do amin katecholowych. Adrenalina, podstawowy produkt rdzenia nadnerczy (stanowi 80% katecholoamin uwalnianych z rdzenia nadnerczy) syntetyzowana w nim i magazynowana, jest wydzielana do krążenia głównie w stresie. Noradrenalina jest wytwarzana nie tylko w rdzeniu nadnerczy, lecz również w pozazwojowych włóknach układu współczulnego, syntetyzowana z aminokwasu tyrozyny, podlega następnie konwersji do adrenaliny w odpowiedzi na kortyzol uwalniany z kory nadnerczy. Dopamina, prekursor noradrenaliny, pełni przede wszystkim funkcję neuroprzekaźnika w ośrodkowym układzie nerwowym, a w mniejszych ilościach produkują ją nadnercza i obwodowe zwoje współczulne.
Komórki rdzenia nadnerczy magazynują katecholaminy w granulkach cytoplazmatycznych, następnie są one uwalniane pod wpływem acetylocholiny do naczyń włosowatych. Katecholaminy wywierają różnorodne działania na procesy metaboliczne i układ sercowo-naczyniowy, uwalniane są w odpowiedzi na stres, wysiłek fizyczny, ból, wstrząs, hipoglikemię czy np. bezpośrednio przed egzaminem. Działają szybciej niż kortyzol – aktywacja układu współczulno-nadnerczowego nie podlega regulacji przez przysadkę.
Hormony rdzenia nadnerczy działają na błonowe receptory adrenergiczne związane z kilkoma rodzajami białek G, wywierając wielokierunkowe działanie na różne układy organizmu człowieka. Efekt biologiczny przekazywanego sygnału zależy od typu receptora i rodzaju komórki. Funkcję drugiego przekaźnika pełnią jony wapnia (receptory α1) lub cyklaza adenylanowa (receptory α2 i β). Efekty pobudzenia receptorów należących do różnych klas i podtypów znacznie się różnią. Są to między innymi wzrost ciśnienia tętniczego wskutek skurczu mięśniówki naczyń krwionośnych, uwalnianie wolnych kwasów tłuszczowych z komórek tłuszczowych, rozpad glikogenu (substancji zapasowej), rozkurcz oskrzeli, hamowanie perystaltyki jelit.

Ogólnoustrojowe efekty działania amin katecholowych są wypadkową siły działania danej aminy na poszczególne receptory oraz gęstości receptorów w poszczególnych narządach. Noradrenalina silnie działa na receptory α, słabiej na receptory β1, a najsłabiej na receptory β2, dlatego głównym efektem jej działania jest wzrost ciśnienia tętniczego krwi, przyspieszenie czynności serca, zmniejszenie przepływu krwi przez łożysko naczyniowe skóry, nerek, wątroby i mięśni szkieletowych. Adrenalina natomiast kurczy drobne tętniczki w skórze i nerkach, ale dzięki działaniu na receptory β2, rozkurcza naczynia krwionośne w mięśniach szkieletowych i wątrobie. Powoduje również rozkurcz mięśniówki przewodu pokarmowego (oprócz zwieraczy), ciężarnej macicy i oskrzeli. Wywiera liczne działania metaboliczne, zwiększając stężenie glukozy i wolnych kwasów tłuszczowych we krwi – ważnych substratów dla mięśni w „reakcji walki lub ucieczki” występującej w stresie.
Katecholoaminy krążą we krwi w formie związanej z albuminą. Degradowane są w wątrobie przez dwa enzymy: monoaminooksydazę (MAO) i katecholo-orto-metylotransferazę (COMT).
Adrenalina i noradrenalina obecne są w surowicy krwi, wydalane są z moczem w postaci niezmienionej oraz w postaci metabolitów – ulegają przekształceniu do kwasu wanilinomigdałowego (VMA lub HMMA), który jest wydalany z moczem. Stężenia VMA oznaczane są w moczu w celu diagnostyki guza chromochłonnego – rzadkiego nowotworu rdzenia nadnerczy
Wskazania do badania katecholamin:
- potwierdzenie lub wykluczenie guza chromochłonnego nadnerczy, podejrzewanego w przypadku objawów, takich jak: napadowe nadciśnienie tętnicze, rzadziej utrwalone; bóle głowy, zlewne poty, bladość skóry, hipotensja ortostatyczna (nagły spadek ciśnienia tętniczego po pionizacji, czyli zmianie pozycji ciała z leżącej na stojącą), dolegliwości bólowe w obrębie jamy brzusznej, nudności, wymioty, zaparcia, niewyjaśniona utrata masy ciała, zaburzenia rytmu serca;
- podejrzenie obecności nerwiaka zarodkowego (neuroblastoma), przede wszystkim u dzieci (objawy: ból brzucha, klatki piersiowej, pleców, kości, bezbolesne guzki podskórne, niewyjaśniona utrata masy ciała, kaszel, duszność, stany podgorączkowe);
- ocena skuteczności leczenia guza chromochłonnego nadnerczy, ocena nawrotów;
- ocena wydzielania katecholamin w guzach neuroendokrynnych, guzach nadnerczy;
- u osób z silnie obciążonym wywiadem rodzinnym w kierunku guza chromochłonnego;
- ocena pacjentów z dysfunkcjami w obrębie autonomicznego układu nerwowego, z neuropatią autonomiczną.
Zaburzenia czynności nadnerczy
Zaburzenia czynności nadnerczy polegają na wytwarzaniu przez nie nadmiaru hormonów (nadczynność), niedostatecznej ich czynności (niedoczynność) lub dysproporcji między wytwarzaniem poszczególnych grup hormonalnych (bloki enzymatyczne). Przyczyna tych zaburzeń może tkwić w samych nadnerczach albo może wynikać z nieprawidłowego ich pobudzenia.
Cztery najważniejsze choroby związane z hormonami kory nadnerczy występują stosunkowo rzadko i są to:
- Zespół Cushinga – przewlekłe, nadmierne wydzielanie kortyzolu
- Choroba Cushinga – spowodowana guzem wydzielającym ACTH
- Zespół Conna – guz wydzielający aldosteron
- Choroba Addisona – niedobór kortyzolu i aldosteronu
Zespół Conna i zespół Cushinga są ważnymi przyczynami nadciśnienia tętniczego na tle endokrynnym.
Niedoczynność kory nadnerczy – przyczyny i diagnostyka
Niedoczynność kory nadnerczy, wynikająca z uszkodzenia obu narządów, pojawia się, gdy zniszczeniu ulega co najmniej 90% ich masy – mówi się wówczas o niedoczynności pierwotnej. Niedoczynność rozwijająca się na skutek braku pobudzającego działania ACTH to wtórna niedoczynność kory nadnerczy. Może ona być następstwem uszkodzenia przysadki (brak ACTH) lub podwzgórza (brak CRF i w konsekwencji brak ACTH).
Najczęstszą przyczyną niedoczynności kory nadnerczy jest proces autoimmunizacyjny, w części przypadków (nawet do 10%) choroba może rozwinąć się na skutek nacieku nowotworowego lub procesu gruźliczego.
W diagnostyce niedoczynności kory nadnerczy podstawowymi badaniami są oznaczenia stężenia kortyzolu i ACTH w surowicy. Oznaczenie kortyzolu wykonuje się w godzinach porannych i wieczornych. Natomiast oznaczenie stężenia ACTH powinno być wykonane w warunkach szpitalnych, ze względu na ograniczenia stabilności parametru w badanym materiale i możliwość popełnienia błędu przedlaboratoryjnego. Bardzo istotne w diagnostyce są badania obrazowe.
PNKN → pierwotna niedoczynność kory nadnerczy – choroba Addisona lub cisawica to rzadkie schorzenie endokrynologiczne, którego powodem jest niedobór hormonów kory nadnerczy.
Niecharakterystyczne objawy niedoczynności kory nadnerczy to:
- osłabienie, zmniejszona tolerancja wysiłku fizycznego,
- utrata łaknienia,
- nudności, wymioty,
- luźne stolce,
- ból mięśni i stawów,
- zasłabnięcia (wskutek hipotensji ortostatycznej lub hipoglikemii).
Charakterystyczne natomiast jest:
- ciemnienie skóry szczególnie w miejscach narażonych na działanie promieni słonecznych lub ucisk,
- brunatne przebarwienia kości, linii zgięć na dłoniach i grzbiecie rąk, otoczek brodawek sutkowych, blizn.
Nierozpoznana pierwotna niedoczynność kory nadnerczy może doprowadzić do przełomu nadnerczowego, który jest bezpośrednim zagrożeniem życia.
Nadczynność kory nadnerczy – przyczyny i diagnostyka
Nadczynność kory nadnerczy w zakresie wydzielania wszystkich grup hormonów może być pierwotna, czyli niezależna od kortykotropiny – ACTH. Jest wówczas skutkiem powstania w korze nadnerczy guza (gruczolaka, raka) lub jej rozrostu (hiperplazja).
Wtórna do nadmiaru kortykotropiny – ACTH nadczynność kory nadnerczy to ACTH-zależna jej postać (przy przysadkowym lub ektopowym źródle ACTH).
Objawy nadczynności kory nadnerczy:
- otyłość centralna, z gromadzeniem się tłuszczu na twarzy, karku i w dołkach nadobojczykowych,
- zaczerwienienie twarzy i dekoltu,
- zaniki mięśni obręczy barkowej i miednicznej,
- sinoczerwone rozstępy skóry brzucha, pośladków, czasami kończyn,
- kruchość naczyń – łatwe powstawania siniaków,
- sucha, cienka, pergaminowa skóra – łatwo ulega uszkodzeniom mechanicznym, rany goją się niezwykle trudno,
- zmiany grzybicze (szczególnie często łupież pstry) i ropne (czyraki),
- upośledzona odporność (mogą rozwijać bardzo ciężkie zakażenia bakteryjne i wirusowe oraz uogólnione zakażenia grzybicze),
- liczne zaburzenia metaboliczne.
U chorych z zespołem Cushinga (rzadka choroba, spowodowana przewlekłym nadmiarem glikokortykosteroidów) może wystąpić:
- insulinooporność, skłonność do hiperglikemii,
- nietolerancja glukozy,
- cukrzyca typu 2,
- hipercholesterolemia i hipertriglicerydemia,
- podwyższone stężenie kwasu moczowego,
- nadkrwistość i nadpłytkowość (zwiększone ryzyko powstawania zakrzepów),
- wzrost ciśnienia tętniczego,
- skłonność do hipokaliemii (obniżone stężenie potasu),
- osłabienie wytrzymałości kości i możliwość złamań patologicznych,
- hiperkalciuria – zwiększa ryzyko kamicy nerkowej,
- zmiany dna oka – zmiany naczyniowe, spowodowane nadciśnieniem i cukrzycą,
- wzrost ciśnienia śródgałkowego i zaćma,
- zaburzenia pamięci i funkcji poznawczych,
- bezsenność,
- zaburzenia miesiączkowania lub wtórny brak miesiączki u kobiet,
- zaburzenia erekcji u mężczyzn,
- obniżenie libido u obu płci.
Hiperkortyzolemia może powodować zmiany psychiczne – często są to stany depresyjne, ale w przebiegu zespołu Cushinga opisywano także ciężkie psychozy posteroidowe.
W przypadku podejrzenia hiperkortyzolemii najprostszym, możliwym do wykonania ambulatoryjnie i służącym za test przesiewowy badaniem jest test hamowania 1 miligramem deksametazonu, podanym jednorazowo o godzinie 23.00. Wskazane jest również oznaczenie dobowego rytmu wydzielania kortyzolu. Kolejnym etapem diagnostyki jest oznaczenie porannego stężenia kortykotropiny – ACTH, które ze względu na ograniczenia stabilności parametru w badanym materiale, możliwość popełnienia błędu przedlaboratoryjnego powinno być wykonywane w warunkach szpitalnych, lub materiał do badań powinien być pobierany w Punktach Pobrań znajdujących się wyłącznie przy laboratorium.
Choroba Cushinga:
Termin ten odnosi się do szczególnego nadmiaru glikokortykosteroidów spowodowanego gruczolakiem przysadki i przerostem kory nadnerczy (stymulacja kory nadnerczy przez przysadkę – w komórkach gruczolaka zanika pętla sprzężenia zwrotnego, która hamuje nadmierna wydzielanie ACTH).
Występują objawy zespołu Cushinga z dodatkowym wzrostem pigmentacji skóry. Leczenie choroby Cushinga polega na chirurgicznym usunięciu gruczolaka.
>>> Przeczytaj też: Kortyzol – hormon stresu