Spis treści
- Działanie prozapalne
- Dysfunkcja bariery jelitowej
- Mimikra molekularna
- Biomarkery mikrobioty jelitowej w diagnostyce RZS
- Terapeutyczna modulacja mikrobioty jelitowej i wpływ drobnoustrojów jelitowych na przebieg RZS
- Zależności pomiędzy mikrobiotą jelitową i stosowanymi w RZS lekami
- Metabolity pochodzące z mikrobioty jelitowej
- Podsumowanie
W przewodzie pokarmowym człowieka znajduje się większość komórek odpornościowych organizmu, na które stale oddziałuje mikrobiota jelitowa, regulując ich aktywność i funkcje. Opisywana dwukierunkowa komunikacja mikrobiomu z układem odpornościowym gospodarza zapewnia swoistą równowagę pomiędzy stanem infekcji patogennej i symbiotycznym współistnieniem. Przeprowadzone w ostatnich latach badania kliniczne udowodniły kluczową rolę mikrobioty jelitowej w patogenezie reumatoidalnego zapalenia stawów (RZS). Wpływ na rozwój tej choroby może dokonywać się poprzez mechanizmy obejmujące głównie wytwarzanie metabolitów prozapalnych, upośledzenie bariery błony śluzowej jelit i mimikrę molekularną.
Działanie prozapalne
Bakterie jelitowe o zdolnościach prozapalnych mogą nadmiernie aktywować układ odpornościowy. Antygeny drobnoustrojów jelitowych mogą być prezentowane limfocytom TCD4+ przez komórki dendrytyczne i makrofagi (czyli komórki prezentujące antygen). Prowadzi to do różnicowania i aktywowania zapalnych form limfocytów T. Przykładem takich aktywowanych komórek są Limfocyty Th17 stanowiące podgrupę prozapalnych komórek TCD4+ charakteryzujących się wytwarzaniem interleukiny-17 (IL-17). Regulatorowe limfocyty T (Treg) również pochodzą z limfocytów TCD4+, natomiast wykazują działanie immunosupresyjne, czyli odpowiadają za tłumienie nadmiernej odpowiedzi immunologicznej (Ryc. 1).
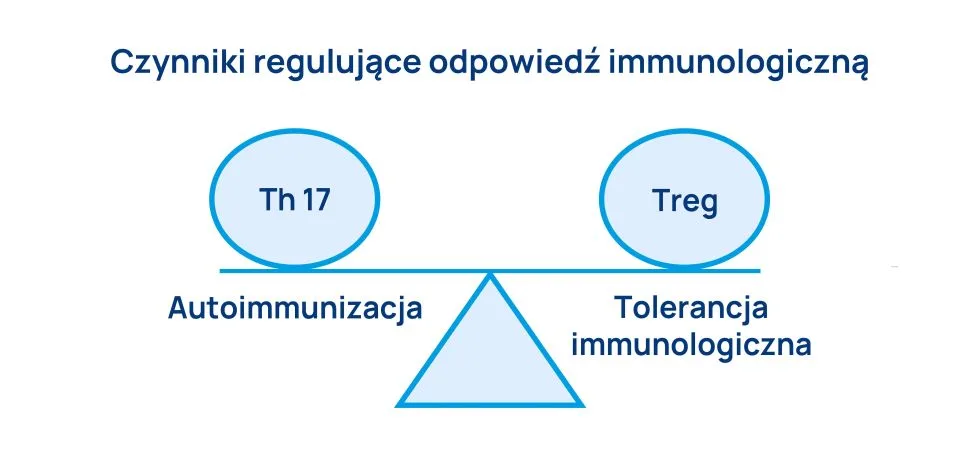
Przeprowadzone badania wykazały, że zwiększony stosunek Th17/Treg jest ściśle powiązany z RZS. Natomiast równowaga Th17/Treg jest w sposób istotny regulowana przez drobnoustroje wchodzące w skład mikrobioty jelitowej, także przez jej metabolity. Limfocyty B również mogą ulec aktywacji poprzez antygeny drobnoustrojów jelitowych i jako komórki plazmatyczne być źródłem patogennych autoprzeciwciał.
Dysfunkcja bariery jelitowej
Głównym elementem bariery jelitowej jest wyściełający przewód pokarmowy nabłonek. Głównym zadaniem tej swoistej warstwy izolującej jest hamowanie wnikania patogenów, toksyn i antygenów pokarmowych do głębszych warstw ściany jelit, a także do światła naczyń krwionośnych. Upośledzona funkcja bariery jelitowej może zwiększać przepuszczalność jelit, prowadząc do translokacji bakterii jelitowych do krwioobiegu. Wyzwala to niekontrolowaną miejscową reakcję immunologiczną w jelitach, a także ogólnoustrojową odpowiedź zapalną. Warto zaznaczyć, że u pacjentów z RZS, szczególnie w okresie zaostrzenia, obserwowano zaburzenie funkcji bariery jelitowej i zwiększoną przepuszczalność jelit.
Udowodniono również, że zaburzenia mikrobioty jelitowej – czyli stan dysbiozy wiąże się z nasileniem zjawiska translokacji bakteryjnej. Dodatkowo zaburzenia w mikrobiomie jelitowym mogą wyzwalać migrację komórek autoreaktywnych (czyli zdolnych do niszczenia własnych tkanek) do stawów, powodując ich zapalenie. Warto dodatkowo zauważyć, że bakteria Faecalibacterium prausnitzii, ważny element ludzkiej mikrobioty jelitowej, której liczebność jest zmniejszona u pacjentów z RZS, podtrzymuje funkcję bariery jelitowej, utrzymuje równowagę Th17/Treg i wykazuje znaczące działanie przeciwzapalne.
Mimikra molekularna
Zjawisko mimikry molekularnej to podobieństwo pomiędzy antygenami drobnoustrojów a antygenami występującymi w organizmie ludzkim (autoantygenami). Powszechnie akceptowalna jest teza, że sytuacja taka może prowadzić do wytworzenia autoprzeciwciał przeciwko autoantygenom, czyli cząsteczkom, które występują w prawidłowych tkankach. To w konsekwencji prowadzić może do choroby autoimmunologicznej, w której aktywność układu odpornościowego skierowana jest przeciwko własnym tkankom i narządom (Ryc. 2).
Przykładem takiego mechanizmu może być obecność wspólnych sekwencji – czyli podobieństwo budowy cząsteczek – pomiędzy zamieszkującym nasze jelita drobnoustrojem Collinsella i białka HLA-DRB1*0401. Postuluje się, że Collinsella może indukować RZS poprzez mimikrę molekularną.
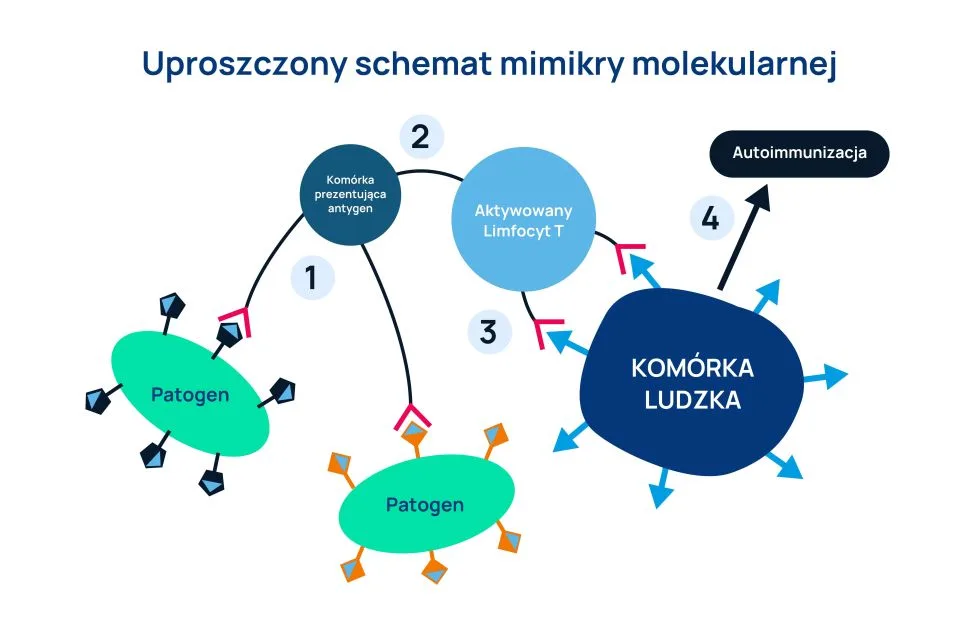
- Komórki prezentujące antygen limfocytom T rozpoznają i prezentują patogeny.
- Limfocyty T zostają aktywowane poprzez rozpoznanie antygenu patogenu.
- Aktywowane przez patogen limfocyty T rozpoznają własne antygeny.
- To prowadzi do wyzwolenia procesu autoimmunologicznego.
Biomarkery mikrobioty jelitowej w diagnostyce RZS
Przeprowadzone badania sugerują, że zmiany w mikrobiocie jelitowej mają wpływ na nasilenie objawów RZS. Dodatkowo niektórzy z autorów sugerują, że wybrane drobnoustroje mikrobiomu mogą służyć jako biomarkery w diagnozowaniu RZS. Scher i wsp. udowodnili, że u pacjentów z wczesnym RZS liczebność Prevotella copri była zwiększona, podczas gdy liczebność Bacteroidetes uległa zmniejszeniu. Dodatkowo występowanie P. copri była skorelowana ze zmniejszeniem liczebności innych grup bakterii, w tym wielu pożytecznych drobnoustrojów. W analizie mikrobioty jelitowej chorych we wczesnym stadium RZS obserwowano zwiększoną liczebność i różnorodność gatunkową Lactobacillus w porównaniu z osobami zdrowymi. Co ciekawe różnice w mikrobiocie jelitowej uzależnione są również od aktywności RZS. Większa względna liczebność rodzajów Collinsella i Akkermansia obserwowana była u pacjentów w aktywnej fazie choroby, w porównaniu z fazą remisji tej choroby.
Tak jak już wspomniano, jedną z najbardziej charakterystycznych zmian zachodzących w mikrobiocie jelitowej pacjentów z przedklinicznym RZS jest wzrost liczebności Prevotella copri. Obecność materiału genetycznego tej bakterii (rDNA 16S) w płynie maziowym z jamy stawowej pacjentów z wczesnym RZS może sugerować potencjalną rolę tego drobnoustroju w wywoływaniu zapalenia stawów. Co ciekawe, produkcja przeciwciał przeciwko Prevotella copri jest specyficzna dla pacjentów z RZS i rzadko obserwowana u osób z innymi chorobami reumatycznymi.
Terapeutyczna modulacja mikrobioty jelitowej i wpływ drobnoustrojów jelitowych na przebieg RZS
Przeprowadzone w ostatnich latach badania wykazały, że doustne probiotyki i przeszczep mikrobioty jelitowej (ang. fecal microbiota transplantation – FMT) przynoszą obiecujące wyniki, gdy były stosowane jako terapia uzupełniająca w leczeniu RZS. Poprawa kliniczna zachodzi poprzez bezpośrednią i pośrednią modulację mikrobiomu jelitowego. Określone szczepy probiotyczne mogą łagodzić objawy RZS poprzez wytwarzanie naturalnych antybiotyków, wzmacnianie bariery jelitowej, a także korzystnie modyfikując odpowiedź immunologiczną.
Zmiany w mikrobiomie uzyskane poprzez FMT mogą potencjalnie złagodzić objawy RZS. Opisany przypadek pacjenta z opornym na leczenie RZS skutecznie leczonym FMT wskazał, że FMT może mieć doskonały efekt terapeutyczny w leczeniu RZS. Jednakże badań klinicznych oceniających skuteczność FMT u pacjentów z RZS jest jak dotąd niewiele.
Zależności pomiędzy mikrobiotą jelitową i stosowanymi w RZS lekami
Przeprowadzone badania dowiodły, że skład mikrobioty jelitowej pacjentów z RZS może częściowo determinować biodostępność i skuteczność leczenia metotreksatem. Z drugiej strony obserwacje wykazały, że stosowanie metotreksatu u pacjentów z RZS częściowo przywraca prawidłowy skład mikrobiomu jelitowego u tych chorych. Analizując te dane można wysunąć przypuszczenie, że mikrobiota jelitowa może być markerem prognostycznym odpowiedzi klinicznej na metotreksat, jednocześnie wpływając na skuteczność takiego leczenia.
Inny lek modyfikujący przebieg choroby stosowany w RZS, czyli sulfazalazyna, pod wpływem działania azoreduktaz bakteryjnych w jelicie grubym ulega rozszczepieniu na sulfapirydynę i mesalazynę. Sulfapirydyna wpływa na układ immunologiczny i wydaje się normalizować aktywność limfocytów poprzez regulację mikrobioty jelitowej.
W badaniach, w których obserwowano chorych na aktywną postać RZS leczonych sulfasalazyną, zauważono, że terapia tym lekiem wiąże się ze znacznym spadkiem liczebności Clostridium perfringens i Escherichia coli w kale. Dodatkowo stosowanie sulfasalazyny znacząco zmieniło obraz mikrobiotyczny stolca pacjentów z RZS, redukując całkowitą liczebność bakterii beztlenowych, Bacteroides i Escherichia coli, natomiast obserwowane było zwiększenie liczby Bacillus.
Metabolity pochodzące z mikrobioty jelitowej
Mikrobiota jelitowa jest źródłem różnych metabolitów które są syntetyzowane na trzy sposoby:
- metabolity wytwarzane przez bakterie jelitowe w wyniku degradacji i fermentacji składników diety – np. krótkołańcuchowe kwasy tłuszczowe (SCFA, z ang. short-chain fatty acids);
- metabolity syntetyzowane bezpośrednio przez bakterie jelitowe – np. Lipopolisacharyd;
- modyfikacja metabolitów, których źródłem jest gospodarz (człowiek) przez bakterie jelitowe – np. wtórne kwasy żółciowe.
SCFA to grupa związków immunomodulujących, które są silnie powiązane z RZS. Mechanizm działania kwasu masłowego, który jest najlepiej poznanym SCFA, polega na jego wpływie równoważącym funkcjonowanie układu odpornościowego. Jednym z głównych efektów działania kwasu masłowego jest indukowanie polaryzacji limfocytów T regulatoryjnych (Treg), które, jak już wspomniano, są kluczowe w kontrolowaniu reakcji autoimmunologicznych. Dodatkowo kwas masłowy działa hamująco na produkcję cytokin prozapalnych, co przyczynia się do zmniejszenia ogólnoustrojowego stanu zapalnego. Co więcej, kwas masłowy może również hamować powstawanie autoprzeciwciał, prawdopodobnie poprzez blokowanie różnicowania komórek B. Powyższe argumenty dowodzą, że kwas masłowy ma kompleksowy wpływ na funkcjonowanie układu odpornościowego poprzez różnorodne mechanizmy, co może przyczyniać się zmniejszenia ryzyka wystąpienia chorób autoimmunologicznych. Dobrze udowodnionym zjawiskiem jest obniżenie stężenia SCFA u pacjentów z RZS.
Podsumowanie
Powyższe dane potwierdzają istotną rolę mikrobioty jelitowej w patogenezie reumatoidalnego zapalenia stawów. Lepsze zrozumienie tych zależności może prowadzić do optymalizacji strategii terapeutycznych, wykorzystujących modyfikację składu mikrobioty jelitowej. Przyszłe badania powinny skupić się na identyfikacji konkretnych mikroorganizmów i metabolitów, które mogą odgrywać kluczową rolę w tej patologii, co może otworzyć nowe możliwości leczenia i poprawy jakości życia pacjentów z reumatoidalnym zapaleniem stawów.
Piśmiennictwo
- Zhao T, Wei Y, Zhu Y, i wsp. Gut microbiota and rheumatoid arthritis: From pathogenesis to novel therapeutic opportunities. Front Immunol. 2022 Sep 8;13:1007165.
- Lin L, Zhang K, Xiong Q, i wsp. Gut microbiota in pre-clinical rheumatoid arthritis: From pathogenesis to preventing progression. J Autoimmun. 2023 Dec;141:103001.
- Wang Y, Yin Y, Chen X, i wsp. Induction of intestinal Th17 cells by flagellins from segmented filamentous bacteria. Front Immunol (2019) 10:2750.
- Lina C, Conghua W, Nan L, i wsp. Combined treatment of etanercept and MTX reverses Th1/Th2, Th17/Treg imbalance in patients with rheumatoid arthritis. J Clin Immunol (2011) 31(4):596–605.
- Lee, Gap Ryol. The Balance of Th17 versus Treg Cells in Autoimmunity. International Journal of Molecular Sciences 19 (2018): n. pag.
- Manfredo Vieira S, Hiltensperger M, Kumar V, i wsp. Translocation of a gut pathobiont drives autoimmunity in mice and humans. Science. 2018 Mar 9;359(6380):1156-1161.
- Matei DE, Menon M, Alber DG, i wsp. Intestinal barrier dysfunction plays an integral role in arthritis pathology and can be targeted to ameliorate disease. Med. 2021 Jul 9;2(7):864-883.e9.
- Brandl C, Bucci L, Schett G, i wsp. Crossing the barriers: Revisiting the gut feeling in rheumatoid arthritis. Eur J Immunol (2021) 51(4):798–810
- Zhou L, Zhang M, Wang Y, i wsp. Faecalibacterium prausnitzii produces butyrate to maintain Th17/Treg balance and to ameliorate colorectal colitis by inhibiting histone deacetylase 1. Inflammation Bowel Dis (2018) 24(9):1926–40.
- Chen J, Wright K, Davis JM, i wsp. An expansion of rare lineage intestinal microbes characterizes rheumatoid arthritis. Genome Med. 2016 Apr 21;8(1):43.
- Scher JU, Sczesnak A, Longman RS, i wsp. Expansion of intestinal prevotella copri correlates with enhanced susceptibility to arthritis. Elife (2013) 2:e01202.
- Liu X, Zou Q, Zeng B, i wsp.. Analysis of fecal lactobacillus community structure in patients with early rheumatoid arthritis. Curr Microbiol (2013) 67(2):170–6.
- Vaahtovuo J, Munukka E, Korkeamäki M, i wsp. Fecal microbiota in early rheumatoid arthritis. J Rheumatol (2008) 35(8):1500–5
- Zeng J, Peng L, Zheng W, i wsp. Fecal microbiota transplantation for rheumatoid arthritis: A case report. Clin Case Rep (2021) 9(2):906–9.
- Repac J, Mandić M, Lunić T, i wsp. Mining the capacity of human-associated microorganisms to trigger rheumatoid arthritis-A systematic immunoinformatics analysis of T cell epitopes. PLoS One. 2021 Jun 29;16(6):e0253918.
- Yan H, Su R, Xue H i wsp. Pharmacomicrobiology of methotrexate in rheumatoid arthritis: Gut microbiome as predictor of therapeutic response. Front Immunol (2021) 12:789334.]
- Zaharko DS, Bruckner H, Oliverio VT. Antibiotics alter methotrexate metabolism and excretion. Science (1969) 166(3907):887–8.]
- Peppercorn MA, Goldman P. The role of intestinal bacteria in the metabolism of salicylazosulfapyridine. J Pharmacol Exp Ther (1972) 181(3):555–62
- Kanerud L, Scheynius A, Nord CE, i wsp. Effect of sulphasalazine on gastrointestinal microflora and on mucosal heat shock protein expression in patients with rheumatoid arthritis. Br J Rheumatol (1994) 33(11):1039–48. doi: 10.1093/rheumatology/33.11.1039
- Rosser EC, Piper CJM, Matei DE, i wsp. Microbiota-Derived Metabolites Suppress Arthritis by Amplifying Aryl-Hydrocarbon Receptor Activation in Regulatory B Cells. Cell Metab. 2020 Apr 7;31(4):837-851.e10.

