Spis treści
- Czynniki ryzyka chorób krążenia
- Kluczowy wskaźnik Firmicutes/Bacteroidetes (F/B)
- Mikrobiom a zaburzenia gospodarki węglowodanowej
- Metabolity mikrobioty jelitowej
- Dieta jako regulator mikrobioty jelitowej
- Wpływ mikrobioty jelitowej na ciśnienie tętnicze krwi
- Mikrobiom a rozwój miażdżycy
- Podsumowanie
Choroby układu krążenia (choroby sercowo-naczyniowe) stanowią ogromne obciążenie zdrowotne i ekonomiczne w kontekście globalnym. Uważa się je za główną przyczynę zgonów w krajach rozwiniętych. Coraz większa liczba doniesień naukowych wskazuje na niepodważalny związek między mikrobiotą jelitową a chorobami układu krążenia. Wymienia się tu głównie choroby takie jak: miażdżyca naczyń wieńcowych, nadciśnienie tętnicze i niewydolność serca. Co ciekawe zidentyfikowano już konkretne metabolity związane z mikrobiotą jelit, takie jak: N-tlenek trimetyloaminy (TMAO), krótkołańcuchowe kwasy tłuszczowe (SCFA) i kwasy żółciowe, które mają wpływ na rozwój i przebieg tych chorób. Dodatkowo niektóre z tych związków mogą znaleźć zastosowanie w zapobieganiu i leczeniu schorzeń układu krążenia. Dlatego wiedza o związkach mikrobioty jelitowowej z chorobami sercowo-naczyniowymi może przyczynić się do działań mających na celu zmianę przebiegu klinicznego, a także poprawę rokowań u tych chorych.
Czynniki ryzyka chorób krążenia
Ciekawym aspektem wydaje się być również wpływ mikrobioty jelitowej na potwierdzone czynniki ryzyka rozwoju chorób sercowo-naczyniowych. Badacze biorąc pod uwagę liczne interakcje pomiędzy mikrobiotą, a czynnikami ryzyka tych chorób stworzyli również model fizjologiczny osi jelito-serce.
Wśród czynników ryzyka chorób sercowo-naczyniowych, nazywanych modyfikowalnymi wyróżniamy m.in.:
- nadciśnienie tętnicze,
- cukrzycę,
- dyslipidemię,
- otyłość.
Na wszystkie te czynniki oddziałuje mikrobiota jelitowa gospodarza, co wpływa na rozwój, nasilenie objawów i powikłania chorób sercowo-naczyniowych.
Kluczowy wskaźnik Firmicutes/Bacteroidetes (F/B)
Mikrobiota jelitowa każdego z nas kształtuje się indywidualnie, natomiast kluczowym momentem jej formowania jest karmienie piersią, które profiluje mikrobiotę jelitową niemowląt. Gatunkiem dominującym w jelitach niemowląt jest Bifidobacterium longum. Szczep ten znany jest z hamującego wpływu na wzrost Enterobacteriaceae. Należy zaznaczyć, że działanie probiotyczne Bifidobacterium longum ma charakter przejściowy i słabnie wraz z wiekiem. Zmiana równowagi polega na zastąpieniu Bifidobacterium longum przez bakterie beztlenowe, głównie Firmicutes, Bacteroidetes i przedstawicieli archeonów. Taki stan utrzymuje się do końca życia. Natomiast z punktu widzenia oceny mikrobioty kluczowe znaczenie ma stosunek Firmicutes/Bacteroidetes (F/B) (ryc. 1). Warto podkreślić, że wskaźnik F/B wzrasta od urodzenia do dorosłości.
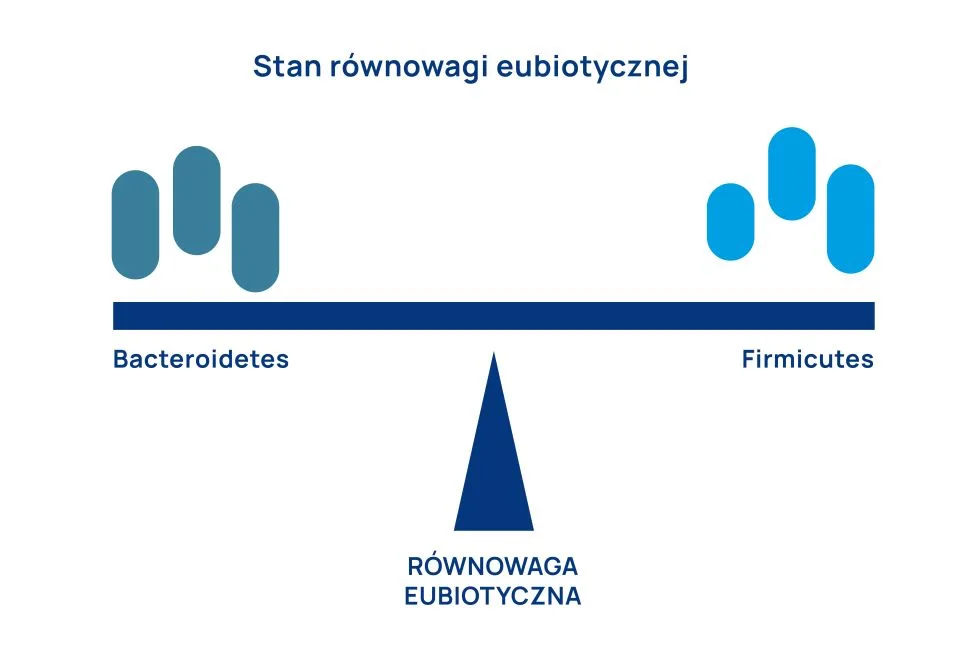
Gram-dodatnie Firmicutes są zdolne do wytwarzania krótkołańcuchowych kwasów tłuszczowych (SCFA, szczególnie maślanu), które pomagają w kontrolowaniu homeostazy glukozy i właściwej regulacji ciśnienia tętniczego krwi. Natomiast Gram-ujemne bakterie Bacteroidetes, oprócz produkcji SCFA (szczególnie octanu i propionianu) wykazują zdolność do degradacji polisacharydów, co wpływa na regulację wchłaniania kalorii. Warto zaznaczyć, że na stosunek F/B znacząco wpływa BMI. Większy udział Firmicutes w stosunku F/B obserwowany jest u chorych z nadwagą i otyłością i wskazuje na większe wykorzystanie kalorii dostarczanych w pożywieniu, co prowadzi do nadmiernego gromadzenia się tkanki tłuszczowej. Wysoki stosunek F/B może być związany z podwyższonym ryzykiem wystąpienia zespołu metabolicznego, cukrzycy i otyłości.
Mikrobiom a zaburzenia gospodarki węglowodanowej
Jedno z badań wykazało, że u osób ze stanem przedcukrzycowym stosujących dietę obserwuje się zmniejszenie liczebności Prevotella i zwiększenie liczebności Faecalibacterium prausnitzii. Dodatkowo obserwowany był również wzrost liczby bakterii kwasu mlekowego (Lactobacteriaceae). Rezultaty badań sugerują, że wzrost pożytecznych bakterii w mikrobiocie jelitowej pacjentów stosujących zdrową dietę może chronić przed rozwojem cukrzycy typu 2 w populacjach osób otyłych, w podeszłym wieku i ze stanem przedcukrzycowym. Dodatkowo u otyłych pacjentów z cukrzycą typu 2 stwierdzano brak bakterii Verrucomicrobia phyla, mikroorganizmu o udowodnionym działaniu przeciwzapalnym na jelita i co ważne, pomagającym poprawić wrażliwość na insulinę.
Metabolity mikrobioty jelitowej
Warto przyjrzeć się niektórym metabolitom związanym z aktywnością mikrobioty jelitowej, które, jak się wydaje, mogą mieć kluczową rolę w rozwoju chorób sercowo-naczyniowych.
Niektóre z zamieszkujących nasz przewód pokarmowy bakterii potrafią dokonywać przemiany choliny, lecytyny i karnityny w trimetyloaminę (TMA). Warto podkreślić, że cholina, lecytyna i karnityna zawarte są przede wszystkim w pokarmach pochodzenia zwierzęcego. TMA wchłania się do krwioobiegu i w wątrobie jest utleniana przez monooksygenazy flawinowe do N-tlenku TMA (TMAO). Związek ten wydaje się mieć kluczowe znaczenie nie tylko w rozwoju chorób sercowo-naczyniowych, ale i określaniu ryzyka występowania ich powikłań (Ryc. 2). Liczne badania wykazują, że podwyższony poziom TMAO wiąże się z niekorzystnymi następstwami chorób sercowo-naczyniowych. Dodatkowo wysokie stężenie TMAO w osoczu było powiązane ze wzrostem śmiertelności, zwłaszcza z powodu chorób układu krążenia i nerek.
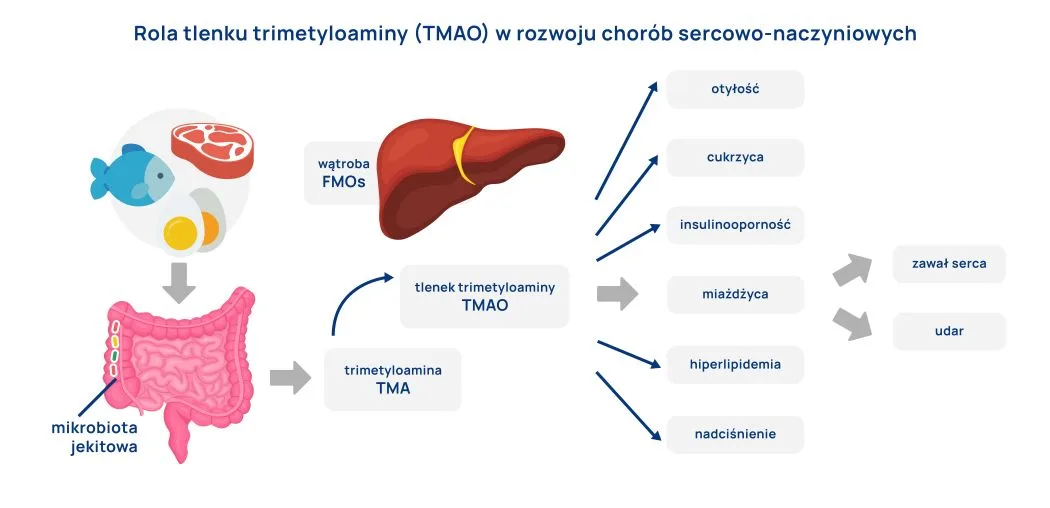
Co ciekawe zwiększona ilość TMAO w krążeniu ogólnoustrojowym powoduje zmniejszenie usuwania cholesterolu i przyczynia się do rozwoju miażdżycy. Dodatkowo udowodniono, że TMAO wpływa na zwiększenie reaktywności płytek krwi i zwiększa ryzyko zakrzepicy.
Dieta jako regulator mikrobioty jelitowej
Potwierdzono, że dieta śródziemnomorska (bogata w błonnik, nienasycone kwasy tłuszczowe oraz owoce i warzywa) wiąże się ze wzrostem liczebności Prevotella i Firmicutes, natomiast dieta uboga w te składniki powoduje podwyższenie stężeń TMAO. Stwierdzono, że w porównaniu do diety śródziemnomorskiej, dieta zachodnia (uboga w błonnik, ale bogata w nasycone kwasy tłuszczowe i białka zwierzęce) zmniejsza różnorodność drobnoustrojów mikrobioty jelitowej, zmniejszając liczbę pożytecznych gatunków, należących m.in. do Bifidobacterium i Eubacterium.
Wpływ mikrobioty jelitowej na ciśnienie tętnicze krwi
Zwiększona produkcja krótkołańcuchowych kwasów tłuszczowych (SCFA) przez wybrane gatunki wchodzące w skład mikrobioty jelitowej wiąże się z obserwowanym obniżeniem ciśnienia tętniczego krwi. Dysbioza jelitowa, której konsekwencją jest m.in. zmniejszenie produkcji SCFA i zwiększony stosunek F/B, prowadzi to do nasilenia ogólnoustrojowego stanu zapalnego. Warto natomiast zauważyć, że obniżenie ciśnienia krwi przez SCFA wiąże się ze zmniejszeniem ogólnoustrojowego stanu zapalnego poprzez regulację limfocytów T i zmniejszeniem zmian miażdżycowych w aorcie.
Jako szczególnie korzystne w aspekcie regulacji ciśnienia krwi należy wymienić zamieszkujące jelita bakterie Lactobacilli. Działanie obniżające ciśnienie krwi przez Lactobacilli jest częściowo skorelowane z wydzielaniem przez te bakterie peptydów hamujących konwersję angiotensyny I do silnie kurczącej naczynia krwionośne angiotensyny II. To właśnie dlatego w pewnym stopniu tłumaczone może być zjawisko niższego ciśnienia krwi u kobiet (przed menopauzą) w porównaniu z mężczyznami. Kobiety bowiem wykazują większą proporcję bakterii Lactobacilli w jelitach w porównaniu z mężczyznami.
Co ciekawe, u osób z nadciśnieniem tętniczym stwierdzono zmniejszoną różnorodność mikrobioty jelitowej, przy znacznym wzroście liczebności rodzaju Prevotella. Dodatkowo bakterie należące do rodzajów Bifidobacterium, Lactobacillus, Streptococcus, a także Escherichia coli mogą poprzez wytwarzane neuroprzekaźniki zwiększać napięcie mięśniówki naczyń, prowadząc do nadciśnienia tętniczego. Udowodniono również, że wysokie stężenie krążącego TMAO jest powiązane z podwyższonym ryzykiem wystąpienia nadciśnienia tętniczego.
Bardzo ciekawym zjawiskiem okazała się zaobserwowana zależność pomiędzy skutecznością działania leków hipotensyjnych (przeciwnadciśnieniowych) a obserwowanymi w trakcie ich przyjmowania zmianami w mikrobiocie jelitowej. W badaniach przeprowadzonych na modelu zwierzęcym udowodniono, że lek Captopril (jeden z leków z grupy inhibitorów enzymów konwertujących angiotensynę) zwiększa liczebność Allobaculum, a jego działanie przeciwnadciśnieniowe było obserwowane nawet po odstawieniu leku. Inne leki hipotensyjne (Kandesartan i Irbesartan), zapobiegają zaburzeniom mikrobioty jelitowej poprzez zachowanie liczebności Lactobacillus i jako takie normalizują stosunek F/B.
Mikrobiom a rozwój miażdżycy
Stwierdzenie w blaszkach miażdżycowych cząstek DNA pochodzących od różnych gatunków bakterii stanowiło jeden z pierwszych dowodów na udział drobnoustrojów w rozwoju miażdżycy. Co wydaje się szczególnie interesujące, autorzy prac potwierdzili, że filotypy bakterii występujące w blaszkach miażdżycowych wykazują podobieństwo do filotypów występujących w jamie ustnej i jelicie tego samego osobnika. Obserwacje te dowodzą na możliwy udział mikrobioty jelitowej (jako odległego środowiska bakteryjnego) w rozwoju miażdżycy naczyń.
Z punktu widzenia przebiegu i powikłań chorób sercowo-naczyniowych ważnym zjawiskiem jest zwapnienie blaszki miażdżycowej. Zwapniała blaszka miażdżycowa powoduje stwardnienie i sztywność naczynia. Natomiast pęknięcie blaszki miażdżycowej może być powodem zawału serca lub udaru mózgu. Badania przeprowadzone przez Sayols-Baixeras i wsp. zidentyfikowały aż 64 gatunki bakterii obecnych w jelitach, które miały związek ze zwapnieniem blaszki miażdżycowej. Natomiast najsilniejszy związek obserwowano w przypadku dwóch gatunków paciorkowców obecnych w jamie ustnej– Streptococcus anginosus oraz Streptococcus oralis subsp. oralis.
Podsumowanie
Niewątpliwie skomplikowane zależności pomiędzy mikrobiotą jelitową a chorobami sercowo-naczyniowymi nie zostały całkowicie poznane. Z uwagi na globalny charakter problemu, jakie niosą ze sobą konsekwencje tych chorób, zagadnienie to wymaga dalszych badań. Obserwacje, którymi aktualnie dysponujemy, pozwalają na przypuszczenie, że w przyszłości możliwa jest interwencja dotycząca modyfikacji mikrobioty jelitowej w ramach profilaktyki i leczenia chorób sercowo-naczyniowych.
Piśmiennictwo
- Bhat MA, Mishra AK, Tantray JA, i wsp. Gut Microbiota and Cardiovascular System: An Intricate Balance of Health and the Diseased State. Life (Basel). 2022 Nov 28;12(12):1986.
- Underwood M.A., German J.B., Lebrilla C.B. i wsp. Bifidobacterium longum subspecies infantis: Champion colonizer of the infant gut. Pediatr. Res. 2014;77:229–235.
- Kozak K., Charbonneau D., Sanozky-Dawes R. i wsp. Characterization of bacterial isolates from the microbiota of mothers’ breast milk and their infants. Gut Microbes. 2015;6:341–351.
- Blanton L.V., Barratt M.J., Charbonneau M.R., Ahmed T., Gordon J.I. Childhood undernutrition, the gut microbiota, and microbiota-directed therapeutics. Science. 2016;352:1533.
- Kallus S.J., Brandt L.J. The Intestinal Microbiota and Obesity. J. Clin. Gastroenterol. 2012;46:16–24.
- Turnbaugh P.J., Ley R.E., Mahowald M.A. i wsp. An Obesity-Associated Gut Microbiome with Increased Capacity for Energy Harvest. Nature. 2006;444:1027–1031.
- Merkevičius K, Kundelis R, Maleckas A, i wsp. Microbiome Changes after Type 2 Diabetes Treatment: A Systematic Review. Medicina (Kaunas). 2021 Oct 11;57(10):1084.
- Matijašić B.B., Obermajer T., Lipoglavšek L. i wsp. Association of dietary type with fecal microbiota in vegetarians and omnivores in Slovenia. Eur. J. Nutr. 2013;53:1051–1064.
- Yang G, Jiang Y, Yang W. i wsp. Effective treatment of hypertension by recombinant Lactobacillus plantarum expressing angiotensin converting enzyme inhibitory peptide. Microb Cell Fact. 2015 Dec 21;14:202.
- Yang T, Aquino V, Lobaton GO, i wsp. Sustained Captopril-Induced Reduction in Blood Pressure Is Associated With Alterations in Gut-Brain Axis in the Spontaneously Hypertensive Rat. J Am Heart Assoc. 2019 Feb 19;8(4):e010721.
- Sayols-Baixeras S, Dekkers KF, Baldanzi G,i wsp. Streptococcus Species Abundance in the Gut Is Linked to Subclinical Coronary Atherosclerosis in 8973 Participants From the SCAPIS Cohort. Circulation. 2023 Aug 8;148(6):459-472