Spis treści
- Hemochromatoza – co to jest?
- Hemochromatoza – objawy
- Co powoduje hemochromatozę dziedziczną?
- Hemochromatoza – leczenie
- Jak zdiagnozować hemochromatozę?
- Jak zapobiegać powikłaniom hemochromatozy?
Hemochromatoza – co to jest?
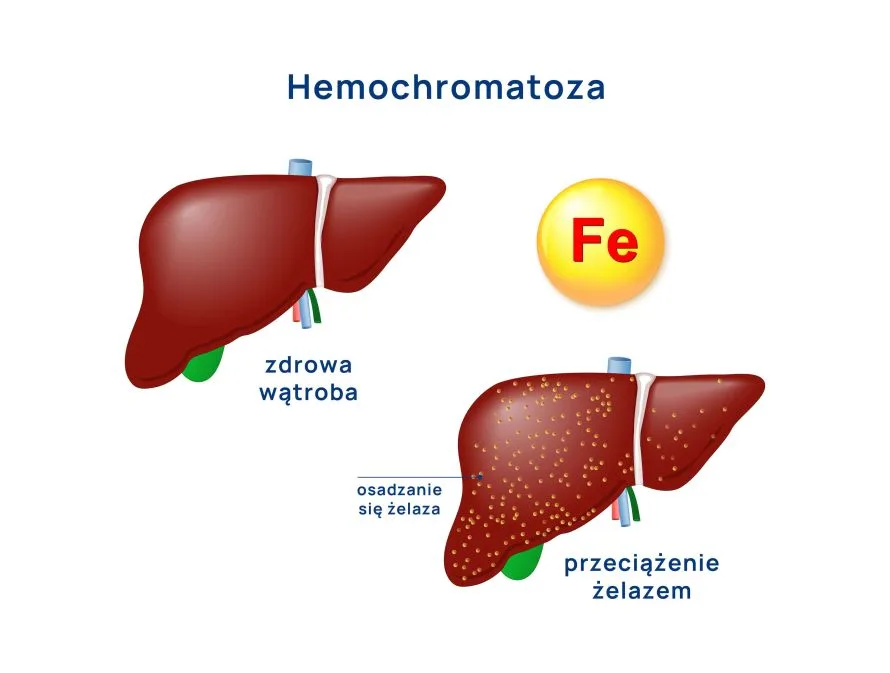
Hemochromatoza dziedziczna jest chorobą najczęściej autosomalnie recesywną, która zaburza homeostazę żelaza, powodując ogólnoustrojowe przeciążenie organizmu żelazem.
Odkładanie się nadmiaru żelaza w komórkach miąższowych prowadzi do dysfunkcji komórkowych i klinicznych objawów choroby. Najczęściej zajętymi narządami są wątroba, trzustka, stawy, serce, skóra i przysadka mózgowa. Zaawansowana hemochromatoza może prowadzić do:
- marskości wątroby,
- raka wątrobowokomórkowego,
- kardiomiopatii,
- artretyzmu,
- cukrzycy.
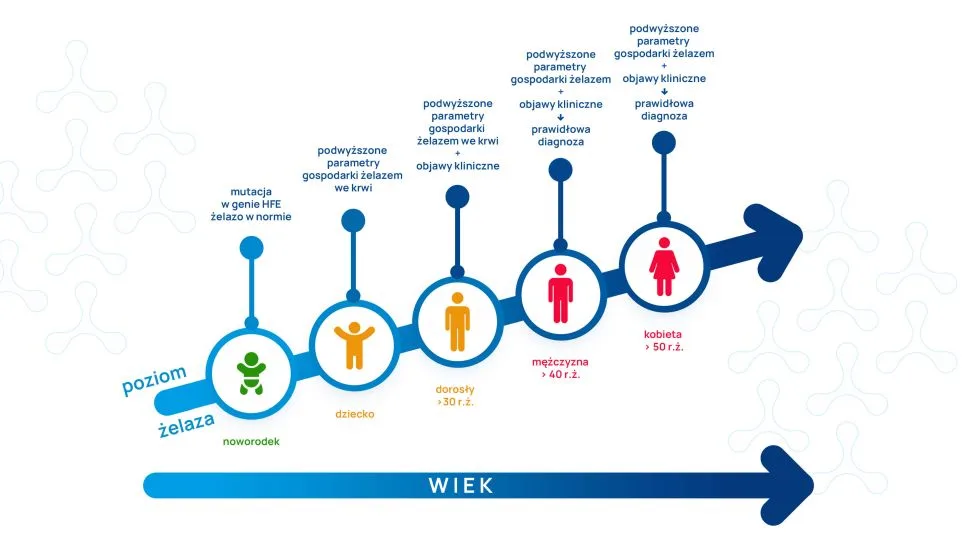
Hemochromatoza dziedziczna zwykle jest diagnozowana w wieku 40 lat u mężczyzn i 50 lat u kobiet. Kobiety diagnozowane są później niż mężczyźni, z powodu comiesięcznej utraty krwi menstruacyjnej. Nie ma typowej prezentacji i objawów hemochromatozy dziedzicznej, a ze względu na zwiększoną świadomość prozdrowotną i wczesną diagnostykę uszkodzenia narządów końcowych objawy wtórne do przeładowania żelazem nie są dzisiaj często obserwowane w praktyce klinicznej. Częstą sytuacją jest pacjent z nieznacznie podwyższoną aktywnością enzymów wątrobowych (AspAT, AlAT oraz GGTP), u którego później stwierdza się podwyższoną wartość wysycenia ferrytyną i transferyną w surowicy. Poziom ferrytyny większy niż 300 ng/ml dla mężczyzn i 200 ng/ml dla kobiet oraz wysycenie transferyny większe niż 45% wysoce sugerują hemochromatozę dziedziczną.
Wiele osób z hemochromatozą dziedziczną nie wie, że ją ma, gdyż jej wczesne objawy, takie jak uczucie zmęczenia lub osłabienia, są powszechne i mogą powodować mylenie jej z wieloma innymi chorobami.
Hemochromatoza – objawy
Objawy hemochromatozy obejmują:
- uczucie zmęczenia lub osłabienia,
- utratę masy ciała,
- bóle stawowe,
- brązowy lub szary kolor skóry,
- bóle brzucha,
- utrata popędu płciowego.
Mężczyźni z dziedziczną hemochromatozą są bardziej narażeni na powikłania i często występują one w młodszym wieku. Szacuje się, że u około 9% (około 1 na 10) mężczyzn z dziedziczną hemochromatozą rozwinie się ciężka choroba wątroby. Jednak u większości osób z hemochromatozą dziedziczną nigdy nie występują objawy ani powikłania. Hemochromatozę nazywa się najczęstszą choroba rzadką wśród osób pochodzenia północnoeuropejskiego. Pomimo dużej częstości występowania mutacji genu HFE w populacji (mutacje genu HFE najczęściej są przyczyną hemochromatozy) penetracja kliniczna jest niska i zmienna i do 25% osób z homozygotyczną mutacją C282Y jest klinicznie bezobjawowych. Dziedziczna postać hemochromatozy rzadko występuje u osób pochodzenia azjatyckiego, afrykańskiego, latynoskiego i mieszkańców wysp Pacyfiku.
Co powoduje hemochromatozę dziedziczną?
Hemochromatoza dziedziczna najczęściej, bo w 95% przypadków spowodowana jest mutacjami w genie HFE i zalicza się je do typu 1 (1a,1b,1c) hemochromatozy. Pozostałe typy (2, 3, 4) związane są z mutacjami w innych genach związanych z gospodarką żelaza, są formami bardzo rzadkimi tej choroby i częstość występowania to mniej niż 5% wszystkich przypadków z hemochromatozą (patrz tabela):

Hemochromatoza – leczenie
Upuszczanie krwi, czyli tzw. flebotomia jest podstawową techniką leczenia hemochromatozy i może pomóc poprawić czynność serca, zmniejszyć nieprawidłową pigmentację skóry i zmniejszyć ryzyko powikłań wątrobowych, w tym redukcję stopni marskości. Każdorazowy upust ok. 500 ml krwi powoduje wydalenie z organizmu ok. 250 mg żelaza. Częstość flebotomii ustala się indywidualnie dla każdego pacjenta, najczęściej jest to upust raz na tydzień lub dwa tygodnie w początkowym okresie leczenia, następnie raz na 1-4 miesiące. Warunkiem przystąpienia do upustu jest poziom hemoglobiny powyżej 11g/dL.
Przeszczep wątroby wykonuje się u pacjentów z rakiem wątrobowokomórkowym i ciężką marskością wątroby. Osoby z hemochromatozą dziedziczną mają zwiększone ryzyko wystąpienia raka wątrobowokomórkowego oraz raka jelita grubego i piersi. Tacy pacjenci powinni być objęci częstszymi badaniami USG lub tomografii komputerowej wymienionych narządów.
Terapia chelatująca żelazo obejmująca leki doustne lub dożylne (deferoksamina, deferypron i deferazyroks) i stosowana jest u pacjentów, u których nie można stosować upustów krwi np. z powodu złego stanu żył, ciężkiej anemii lub zastoinowej choroby serca oraz gdy standardowa flebotomia nie powoduje obniżenia poziomu żelaza.
Jak zdiagnozować hemochromatozę?
- wykonanie podstawowych badań krwi obejmujących oznaczenie poziomu enzymów wątrobowych, poziom żelaza, poziom ferrytyny, stopień wysycenia transferyną
Należy pamiętać, że podwyższone poziomy ferrytyny nie zawsze są związane z hemochromatozą, a ferrytyna jako białko ostrej fazy może sugerować ogólny stan zapalny organizmu, uszkodzenie alkoholowe wątroby lub uszkodzenie wątroby z innych powodów. Z kolei zaburzenia poziomu żelaza wykrywane są również innych chorobach (np. w anemii z niedoboru żelaza, w niedoborach witaminy B12, w talasemii, w porfirii), stąd niezwykle ważna jest diagnostyka różnicowa na początkowym etapie.

- wykonanie biopsji wątroby, w celu określenia stopnia jej uszkodzenia lub zastosowanie mniej inwazyjnej techniki oceny uszkodzenia wątroby – rezonansu magnetycznego
- wykonanie badań genetycznych (status mutacji genu HFE) u dorosłych pacjentów
Należy pamiętać, że tylko 10% pacjentów z homozygotyczną mutacją genu HFE ma objawy hemochromatozy, tak więc samo wykrycie mutacji nie jest równoznaczne z zachorowaniem (niska penetracja mutacji HFE). Stąd badania genetyczne zaleca się osobom, które mają w rodzinie krewnych pierwszego stopnia z wykrytą mutacją w genie HFE lub mają wszystkie objawy kliniczne hemochromatozy, lub u tych osób, które nie mają objawów klinicznych, ale mają podwyższone wyniki stężenia żelaza i ferrytyny w surowicy. Wykrycie mutacji w genie HFE, bez podwyższonego stężenia żelaza w surowicy nie daje podstawy do zdiagnozowania hemochromatozy, jednak osoby takie powinny pozostawać pod stałą kontrolą i corocznie wykonywać podstawowe badania krwi wymienione wyżej.

Głównym czynnikiem wpływającym na długość życia chorych z hemochromatozą jest stopień uszkodzenia wątroby (marskości, zwłóknienia) w momencie diagnozy i rozpoczęcia leczenia. Jeśli w momencie rozpoczęcia leczenia, najczęściej upustami krwi, nie ma marskości oraz zwłóknienia wątroby, wtedy długość przeżycia nie różni się u tych pacjentów w porównaniu z osobami zdrowymi.
Jak zapobiegać powikłaniom hemochromatozy?
- częste badania kontrolne krwi w celu sprawdzenia poziomu żelaza,
- zmiany w diecie, takie jak unikanie multiwitamin, suplementów witaminy C i suplementów żelaza, które mogą zwiększać poziom żelaza w organizmie,
- zakaz spożywania alkoholu (ponieważ alkohol zwiększa ryzyko uszkodzenia wątroby),
- kroki zapobiegające infekcjom, w tym niespożywanie niegotowanych ryb i skorupiaków oraz otrzymywanie zalecanych szczepień, w tym przeciwko wirusowemu zapaleniu wątroby typu A i B.
Wszystkie badania laboratoryjne wymienione w tym artykule można wykonać w ALAB laboratoria.
Literatura:
- Kowdley KV, Brown KE, Ahn J, Sundaram V. ACG Clinical Guideline: Hereditary Hemochromatosis. Am J Gastroenterol. 2019 Aug;114(8):1202-1218. doi: 10.14309/ajg.0000000000000315. Erratum in: Am J Gastroenterol. 2019 Dec;114(12):1927. PMID: 31335359.
- Crownover BK, Covey CJ. Hereditary hemochromatosis. Am Fam Physician. 2013 Feb 1;87(3):183-90. PMID: 23418762.
- Adams P, Altes A, Brissot P, Butzeck B, Cabantchik I, Cançado R, Distante S, Evans P, Evans R, Ganz T, Girelli D, Hultcrantz R, McLaren G, Marris B, Milman N, Nemeth E, Nielsen P, Pineau B, Piperno A, Porto G, Prince D, Ryan J, Sanchez M, Santos P, Swinkels D, Teixeira E, Toska K, Vanclooster A, White D; Contributors and Hemochromatosis International Taskforce. Therapeutic recommendations in HFE hemochromatosis for p.Cys282Tyr (C282Y/C282Y) homozygous genotype. Hepatol Int. 2018 Mar;12(2):83-86. doi: 10.1007/s12072-018-9855-0. Epub 2018 Mar 27. PMID: 29589198; PMCID: PMC5904234.

