Spis treści
- Przyczyny SIBO – zespołu rozrostu bakteryjnego jelita cienkiego
- Jakie są objawy SIBO?
- Jak diagnozować SIBO?
- Rodzaje testów oddechowych
- Leczenie SIBO
- SIBO, SIFO i IMO?
SIBO (ang. Small Intestinal Bacterial Overgrowth) to zaburzenie mikrobioty jelitowej polegające na rozroście bakteryjnym w jelicie cienkim. Zespół ten rozwija się w wyniku pojawieniu się i rozroście w jelicie cienkim bakterii, które normalnie bytują w jelicie grubym lub przerostu gatunków bakterii, które zazwyczaj występują w jelicie cienkim w bardzo niewielkiej ilości, a przy SIBO występują w zbyt dużej ilości.
Jelito cienkie jest najdłuższym odcinkiem przewodu pokarmowego. Ma długość ok. 6 m. Jednak bakterii w jelicie cienkim jest zdecydowanie mniej niż w kolejnym odcinku przewodu pokarmowego – jelicie grubym. Fizjologicznie w jelicie cienkim liczba bakterii powinna wynosić: 102 – 105 CFU#/ml (#CFU – jednostki tworzące kolonie). Są to bakterie tlenowe lub względnie beztlenowe, tj. Lactobacillus lub Enterococcus.
Gdy bakterii jest więcej niż 105 CFU#/ml, możemy mówić o nadmiernym rozroście bakteryjnym – SIBO. Poza nieprawidłową ilością chodzi również o skład bakterii – rozrost patologiczny może dotyczyć: Streptococcus viridans i Prevotella spp. pochodzących z jamy ustnej oraz bakterii występujące fizjologicznie w jelicie grubym m.in. Escherichia coli, Clostridium spp., Enterococcus spp., Klebsiella pneumoniae czy Proteus mirabilis.
Przyczyny SIBO – zespołu rozrostu bakteryjnego jelita cienkiego
Występujące w układzie pokarmowym zdrowej osoby mechanizmy działają ochronie i zapobiegają rozwojowi SIBO. Są to m.in. wydzielanie soku żołądkowego, enzymów trzustkowych i żółci, a także prawidłowa perystaltyka jelita, wydzielnicza IgA oraz zastawka krętniczo-kątnicza pomiędzy jelitem cienkim i grubym, zapobiegająca cofaniu płynnej treści. Zaburzenie opisanych mechanizmów sprzyja rozwojowi SIBO.
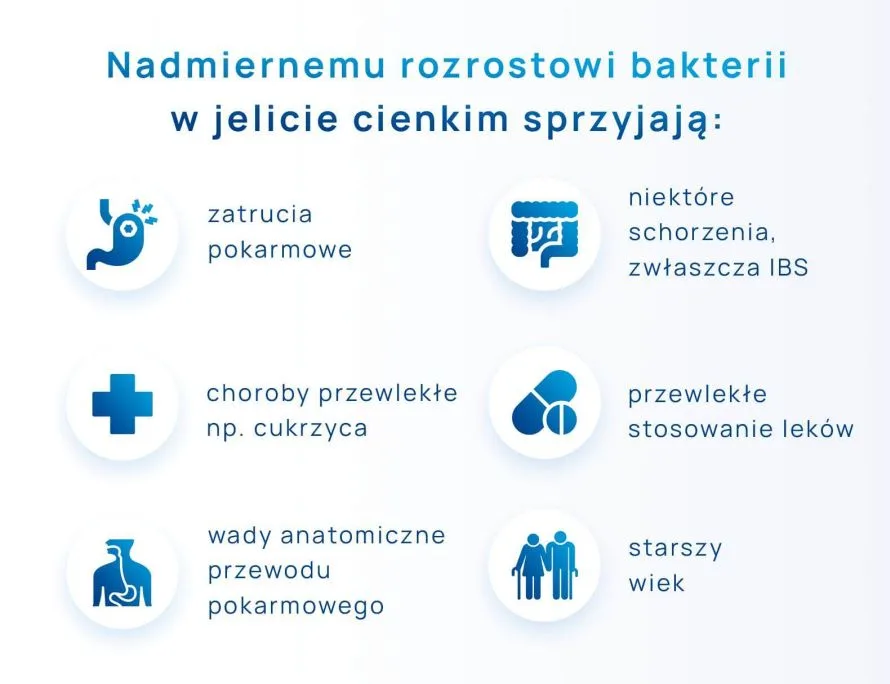
Pozostałe przyczyny patologicznego rozrostu bakterii są złożone. SIBO może wynikać z występowania innych zaburzeń i chorób towarzyszących. Nadmiernemu rozrostowi bakterii w jelicie cienkim sprzyjają:
- zatrucia pokarmowe – są jedną z najczęstszych przyczyn rozwoju SIBO. Podczas zatruć dochodzi najczęściej do długotrwałego uszkodzenia wędrującego kompleksu mioelektrycznego (czyli aktywności elektromechanicznej mięśni gładkich przewodu pokarmowego w przerwach między posiłkami);
- występowanie niektórych schorzeń – szczególnie często SIBO występują łącznie z IBS (ang. irritable bowel syndrome), czyli zespołem jelita nadwrażliwego. U 50-70% pacjentów z zespołem jelita nadwrażliwego może występować SIBO;
- choroby przewlekłe m.in. choroby zapalne jelit (Leśniowskiego-Crohna), cukrzyca, niedoczynność tarczycy, endometrioza, przewlekłe zapalenie trzustki, marskości wątroby;
- przewlekłe stosowanie leków (antybiotyków, inhibitorów pompy protonowej, opioidów);
- SIBO występują często przy wadach anatomicznych przewodu pokarmowego – wrodzonych lub nabytych (np. przetoka operacyjna);
- starszy wiek jest czynnikiem ryzyka i może przyczyniać się do rozwoju SIBO.
Jakie są objawy SIBO?
Główne objawy SIBO to te pochodzące z przewodu pokarmowego – wzdęcia, bóle brzucha i jelit, gazy, biegunka lub zaparcia, zgaga i mdłości. Poza typowymi objawami SIBO ze strony układu pokarmowego mogą występować również: bóle głowy, zmęczenie, utrata masy ciała, a także uszkodzenie wątroby, trądzik różowaty, uszkodzenie nerwów obwodowych, zapalenie i bóle stawów czy kłębuszkowe zapalenie nerek.
Zdarza się, że SIBO (zespół rozrostu bakteryjnego jelita cienkiego) może mieć przebieg bezobjawowy. Jednak należy pamiętać, że nawet przy mniej dokuczliwych objawach niezdiagnozowany, nieleczony i nadmierny rozrost bakterii w jelicie cienkim może skutkować niedożywieniem m.in. z powodu niedoboru witamin (szczególnie witaminy B12).
Jak diagnozować SIBO?
SIBO może być diagnozowane za pomocą pobrania treści z jelita cienkiego i wykonania na jego podstawie posiewu – badania mikrobiologicznego. Jest to jednak metoda inwazyjna, wysokokosztowa i wymagająca doświadczenia endoskopisty przeprowadzającego zabieg.
Ważnym i preferowanym obecnie badaniem w diagnostyce SIBO są testy oddechowe – wodorowo-metanowe z laktulozą lub glukozą. Testy oddechowe są jedną z rekomendowanych przez American College of Gastroenterology – ACG (2020 r.) metod w diagnostyce SIBO. Badania są nieinwazyjne, łatwo dostępne i bardziej komfortowe w przeprowadzeniu dla pacjenta. Wymagają jednak specjalnego przygotowania do badania m.in. stosowania odpowiedniej diety, odpowiednich zaleceń dotyczących przyjmowanych leków itp.
Rodzaje testów oddechowych
W diagnostyce SIBO wykorzystywane są wodorowe testy oddechowe lub wodorowo-metanowe testy oddechowe z obciążeniem glukozą lub laktulozą.
W wersji wodorowo-metanowej testów oddechowych oznaczane jest zarówno stężenie wodoru, jak i metanu.

Według aktualnych wskazań wersja wodorowo–metanowa testów oddechowych zapewnia dokładniejszą diagnostykę, ponieważ znajduje zastosowanie przy obydwu postaciach SIBO – zaparciowej oraz biegunkowej, a także wersji naprzemiennej.
Obciążenie w teście laktulozą, która nie jest wchłaniana w przewodzie pokarmowym, umożliwia określenie ilości niepożądanych bakterii w dystalnym (dalszym) odcinku jelita cienkiego, w przeciwieństwie do glukozy, która wchłania się całkowicie w górnej części jelita cienkiego.
Leczenie SIBO
Celem leczenia SIBO jest zmniejszenie liczby niepożądanych bakterii w jelicie cienkim. Najczęściej u pacjentów ze zdiagnozowanym SIBO stosuje się odpowiednio dobraną antybiotykoterapię. Poza usunięciem przerostu bakteryjnego należy zadbać o uzupełnianie niedoborów pokarmowych, dlatego drugim niezwykle istotnym ważnym elementem leczenia jest dieta. Najczęściej stosowaną jest dieta low-FODMAP, w której ograniczane są produkty zawierające fermentujące związki tj. oligosacharydy, disacharydy, monosacharydy i poliole.
Elementem terapii, który może być dodatkowo stosowany u pacjentów z SIBO, jest probiotykoterapia. Jednak należy zachować szczególną ostrożność przy dobieraniu preparatu przy leczeniu SIBO, ponieważ musi opierać się jedynie na szczepach, które nie będą sprzyjały patologicznemu rozrostowi bakteryjnemu. Nieodpowiednio dobrane probiotyki mogą nasilać objawy SIBO, gdyż w wielu preparatach dostępne są bakterie, które mogą kolonizować także jelito cienkie. Dlatego przed rozpoczęciem probiotykoterapii rekomenduje się, aby wykonać ocenę profilu mikrobioty jelitowej, na podstawie której ekspert może zalecić suplementację probiotyczną.
SIBO, SIFO i IMO?
Niedawno w nomenklaturze dolegliwości związanych z mikrobiotą pojawił się kolejne terminy – IMO (ang. intestinal methanogen overgrowth) oraz SIFO (ang. small intestinal fungal overgrowth). IMO to zespół rozrostu metanogenów w jelitach. Metanogeny, czyli archeony to jednokomórkowe, beztlenowe mikroorganizmy, podobne pod względem budowy do bakterii, które produkują metan. Ponieważ za IMO odpowiadają właśnie archeony, a nie bakterie, według aktualnych wytycznych przerost metanogenów w jelicie definiowany jest osobne schorzenie, czyli IMO.
U ludzi przeważającym metanogenem w jelicie jest Methanobrevibacter smithii. Metanogeny do wytworzenia metanu potrzebują wodoru. Jego źródłem w jelicie cienkim jest fermentacja węglowodanów pod wpływem bakterii. Wodór produkowany przez bakterie jest wykorzystywany przez archeony do metanogenezy.
W związku z opisanym procesem i zależnościami – SIBO i IMO często występują łącznie.
Z kolei SIFO, czyli zespół rozrostu grzybiczego jelita cienkiego, powinien być również diagnozowany jako odrębne schorzenie. Jednak rozpoznanie tego zespołu jest wymagające i często mylone z SIBO. Najczęściej diagnozowana przyczyna SIFO to rozrost grzybów z gatunku Candida albicans – nawet do 84% przypadków. Jednak należy pamiętać, że poza kandydozą jelita, czyli chorobą wywołaną grzybami z rodzaju Candida, w SIFO mogą zostać wykryte inne rodzaje i gatunki grzybów np. Torulopsis glabrata, a także gatunki Penicillium.
Piśmiennictwo:
1. Basseri, R. J. Basseri, B., Piemental, M., Chong, K., Youdim, A., Low, K., Hwang, L., Soffer, E., Chang, C. i Mathur, R. (2012). Intestinal Methane Production in Obese Individuals Is Associated with a Higher Body Mass Index. Gastroenterology and Hepatology, 8(1), 22-28.
2. Katarzyna Kacprzak: IMO. Na czym polega i jak się objawia zespół rozrostu metanogenów w jelitach? Źródło: www.dietetycy.org
3. Szczeklik A., Gajewski P. Interna Szczeklika: Zespół rozrostu bakteryjnego, 2018, s. 2700.
4. Gąsiorowska J., Czerwionka-Szaflarska M. Zespół przerostu flory bakteryjnej jelita cienkiego a zespół jelita nadwrażliwego. Przegląd Gastroenterologiczny 2013; 8 (3), 165-171.
5. Daniluk J. „Postępowanie w zespole rozrostu bakteryjnego jelita cienkiego. Omówienie wytycznych American College of Gastroenterology 2020.” Med. Prakt., 2020;9:39-47
6. Maciej Jabłkowski, Jolanta Białkowska-Warzecha, Aleksandra Jabłkowska. Zespół rozrostu bakteryjnego – SIBO. Jak go diagnozować i leczyć w POZ. Lekarz POZ 2022; 8 (1): 24-36.
7. Małgorzata Desmond: Co to jest SIFO; źródło: https://malgorzatadesmond.com/sifo/