Zespół PANDAS to zespół zaburzeń nerwowo-psychiatrycznych, które mogą pojawiać się u dzieci po przebytej infekcji paciorkowcowej. Choroba ta przyciąga dużą uwagę i jest coraz częściej rozpoznawana.
Definicję dziecięcych autoimmunizacyjnych zaburzeń neuropsychicznych związanych z infekcjami paciorkowcowymi (pediatric autoimmune neuropsychiatric disorders associacted with streptococcal infection – zespół PANDAS) pierwszy raz sformułowano w 1998 roku, natomiast później przedstawiono szersze pojęcie zespołu ostrych dziecięcych zaburzeń neuropsychicznych (pediatric acute-onset neuropsychiatric syndrome – zespół PANS). Od początku choroba ta wzbudzała duże zainteresowanie i bardzo wiele kontrowersji. Nadal nie ustalono, jaką funkcję pełni infekcja paciorkowcowa w nagłym wystąpieniu zaburzeń obsesyjno-kompulsyjnych (obsessive-compulsive disorder – OCD) oraz tików u dzieci, jaki jest naturalny przebieg tych jednostek chorobowych, jaki wpływ ma leczenie objawowe i modyfikujące na przebieg choroby (antybiotykoterapia, immunoterapia oraz leki psychoaktywne).
Dotychczas również ostatecznie nie udowodniono autoimmunizacyjnej etiologii zespołu PANDAS.
Trzeba jednak zauważyć, że zaburzeniu temu poświęca się coraz więcej uwagi i coraz częściej się je rozpoznaje, mimo że pozostaje wiele pytań dotyczących diagnostyki, leczenia i etiologii tego zespołu.
Zespół PANDAS stanowi duże wyzwanie zarówno dla lekarzy, jak i chorych oraz ich rodzin. Dodatkowo niewłaściwe stosowanie kryteriów diagnostycznych wiąże się z ryzykiem zbyt częstego rozpoznania zespołu PANDAS u dzieci, u których występowanie objawów o podłożu immunizacyjnym jest mało prawdopodobne. Rodzice, którzy uważają, że objawy u ich dziecka wskazują na zespół PANDAS, odczuwają strach i frustrację. Wydaje się im, że nikt ich nie słucha, a swoje historie opowiadają w różnych środkach masowego przekazu. Powstało wiele grup wsparcia, takich jak PANDAS Network w Stanach Zjednoczonych czy PANDASHELP w Kanadzie.
Pierwsze kryteria rozpoznania zespołu PANDAS z 1998 r.
- rozpoznane OCD (zaburzenia obsesyjno-kompulsyjne) i/lub zaburzenie tikowe (w dowolnym okresie życia)
- początek objawów w dzieciństwie (pierwszy raz między 3. rokiem życia a początkiem dojrzewania)
- epizodyczny charakter objawów (charakteryzujący się nagłym początkiem objawów lub znaczącymi zaostrzeniami)
- związek z zakażeniem paciorkowcem ß-hemolizującym grupy A
- związek z zaburzeniami neurologicznymi
Kryteria rozpoznania zespołu PANDAS/PANS z roku 2012 r.
1. OCD (zaburzenia obsesyjno-kompulsyjne) o nagłym, poważnym początku lub znaczące ograniczenie spożywania pokarmów (<48 h). Objawy obsesyjno-kompulsyjne muszą być na tyle ciężkie i częste, aby spełniać kryteria rozpoznania OCD wg DSM-IV.
2. Równoległe występowanie dodatkowych objawów neuropsychicznych o podobnym, ciężkim i ostrym początku, z których co najmniej dwa można zakwalifikować do następujących kategorii:
- niepokój,
- labilność emocjonalna i/lub depresja,
- drażliwość, agresywność i/lub poważne zachowania opozycyjne,
- regresja zachowań (rozwoju),
- pogorszenie wyników w szkole,
- trudności sensoryczne/motoryczne,
- objawy somatyczne, w tym zaburzenia snu, moczenie, częstomocz.
3. Objawów nie można lepiej wytłumaczyć znaną chorobą lub zaburzeniem neurologicznym, takim jak pląsawica Sydenhama, toczeń trzewny układowy, zespół Gillesa de la Tourette’a i inne.
Autorzy powyższych kryteriów chcieli, aby nowa definicja zespołu PANS pozwoliła zawęzić grupę chorych i poprawiła także standaryzację badań naukowych.
Nie wiadomo, czy kryteria diagnostyczne zespołu PANS są wystarczająco ścisłe, aby zidentyfikować odrębną klinicznie jednostkę chorobową, jednak przyjęcie jako kryterium nagłego początku objawów psychiatrycznych pozwala wyodrębniać pewną grupę dzieci spośród wszystkich pacjentów skierowanych do oceny w kierunku zespołu PANS. Ostry początek (do 3 dni) obserwowano u 40% chorych diagnozowanych w poradni specjalizującej się w zespole PANS, podczas gdy pozostali spełniali wszystkie kryteria, z wyjątkiem ostrego początku objawów.
W wielu badaniach oceniono związek między zakażeniem a nagłym początkiem objawów neuropsychicznych. Początkowo sugerowano, że objawy występują w ciągu 9 miesięcy po infekcji GAS (paciorkowiec grupy A), jednak wyniki kolejnych badań kliniczno-kontrolnych wykazały zwiększoną liczbę chorych z OCD i zaburzeniami tikowymi w przebiegu poprzedzającej infekcji paciorkowcowej.
Paciorkowiec grupy A (ang. GAS, Group A Streptococcus) to bakteria powszechnie bytująca na skórze i w śluzówce gardła. Większość osób, które wejdą w kontakt z paciorkowcem grupy A, nie chorują i nie mają żadnych objawów, w przypadku zachwiania odporności, paciorkowce wywołują stosunkowo łagodne choroby: np. zapalenia gardła i migdałków (angina), powierzchniowe zapalenia skóry (liszajec). Może jednak dojść do dużo poważniejszych powikłań zakażeń paciorkowcowych np. szkarlatyny (płonica).
Nieprawidłowo leczone i zdiagnozowane infekcje spowodowane przez bakterie Streptococcus z grupy A mogą powodować niebezpieczne w skutkach powikłania, między innymi:
- gorączkę reumatyczną,
- zapalenie płuc,
- zapalenie opon mózgowych,
- martwicze zapalenie powięzi.
I jak się okazało, mogą również dawać początek objawów neuropsychiatrycznych u dzieci. Zespół PANDAS wynika najprawdopodobniej z nadmiernej reakcji układu immunologicznego aktywowanego w wyniku infekcji bakteryjnej. Powstała reakcja zapalna może wpływać na funkcje nerwów, a to z kolei może wywoływać kliniczne objawy neuropsychiatryczne, zaburzenia tikowe i zaburzona koordynację ruchową.
Mechanizm rozwoju tego zespołu chorobowego nie jeszcze poznany. Nie u wszystkich dzieci występują takie same zaburzenia, a zaawansowanie choroby jest cechą bardzo indywidualną. Dlatego właściwe zdiagnozowanie zespołu PANDAS wymaga zarówno od rodziców, jak i specjalistów szczególnego podejścia i zaangażowania. Bardzo istotne jest również wykluczenie dalszego występowania infekcji paciorkowcowej.
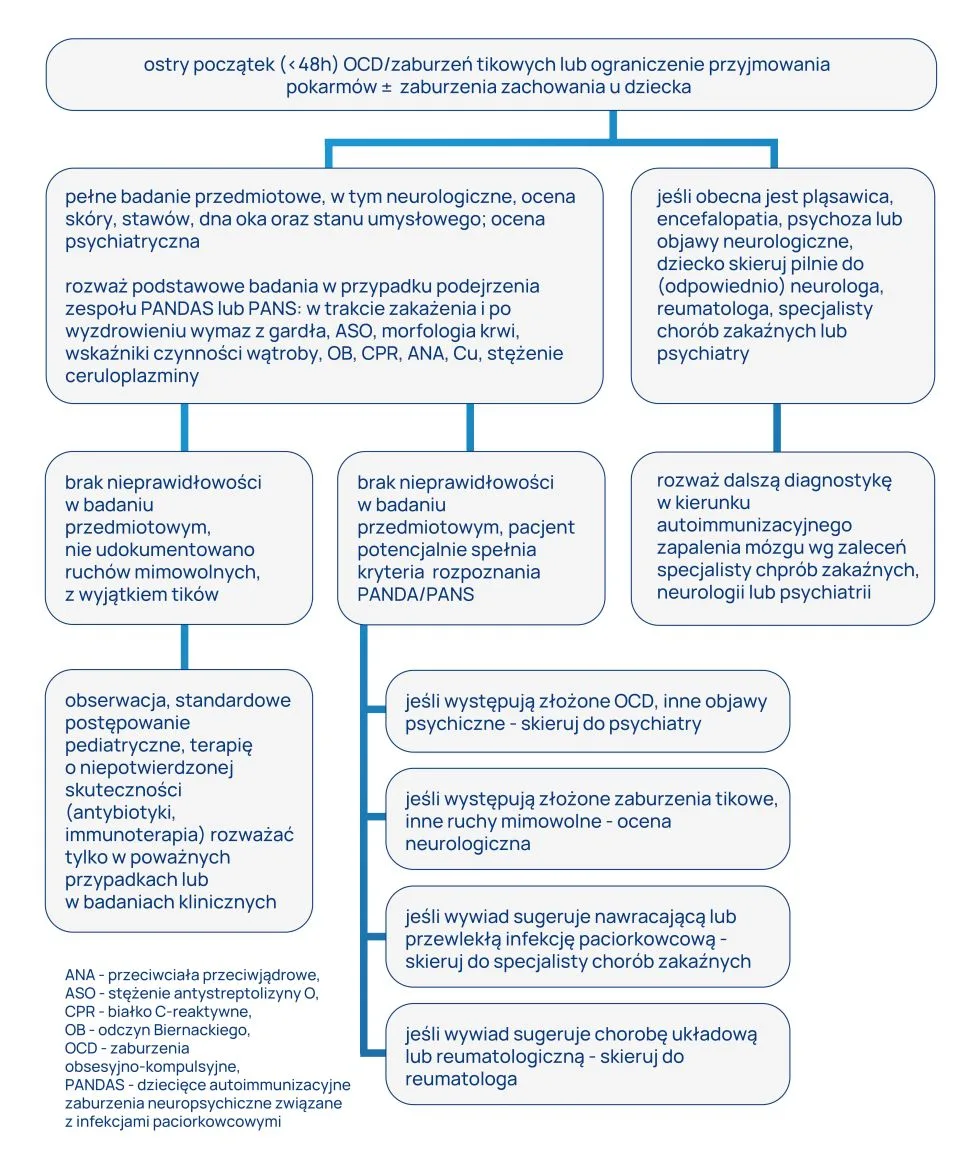
Sugerowany algorytm postępowania diagnostycznego w ocenia dziecka z podejrzeniem zespołu PANDAS/zespołu PANS:
Piśmiennictwo
- Wilbur C.,Bitnum A., Kronemberg S., Laxer R.M., Levy D.m., Logan W.J., Shouldice M, Yeh E.A.: PANDAS/PANS in childhood: Controversies and evidence, Paediatrics &child health 24(2).