Spis treści:
- Żylna choroba zakrzepowo-zatorowa – co to jest?
- Zakrzepica żył głębokich
- Prawdopodobieństwo wystąpienia zakrzepicy żył głębokich
- Zakrzepica żył głębokich – badania
- Zatorowość płuca (ZP)
- Prawdopodobieństwo wystąpienia zatorowości płucnej
- Żylna choroba zakrzepowo-zatorowa – badania
Żylna choroba zakrzepowo-zatorowa – co to jest?
Żylna choroba zakrzepowo-zatorowa jest jedną z najczęstszych chorób układu krążenia.
Żylna choroba zakrzepowo-zatorowa (ŻChZZ), przebiegająca pod postacią zakrzepicy żył głębokich (ZŻG) lub zatorowości płucnej (ZP), jest trzecią pod względem częstości przyczyną ostrego zespołu sercowo-naczyniowego, po zawale serca i udarze mózgu. Zapadalność na tę chorobę wzrasta wraz z wiekiem.
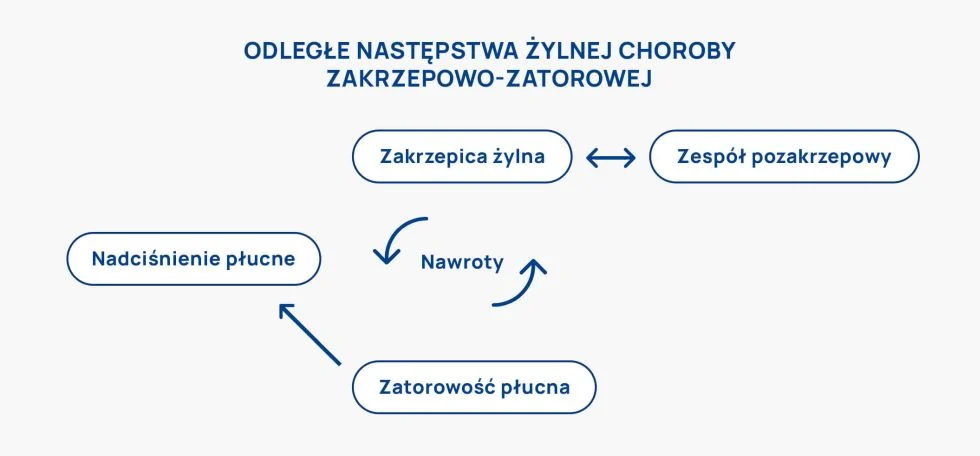
Żylna choroba zakrzepowo-zatorowa występuje prawie 8 razy częściej u osób w wieku ≥80 lat niż w piątej dekadzie życia. Wykrywalność choroby zakrzepowo-zatorowej niestety często jest zbyt późna, co wiąże się z poważnymi komplikacjami i powikłaniami u pacjentów. Istotnymi powikłaniami mogą być: zator płuc, zespół pozakrzepowy (przewlekła niewydolność żylna) oraz nawroty zakrzepicy. Śmiertelność z powodu zatorowości płucnej spowodowanej zakrzepicą żył głębokich wynosi 15–25%, natomiast w przypadku prawidłowego i odpowiednio wcześnie prowadzonego leczenia odsetek ten zmniejsza się wyraźnie do około 2–8%.
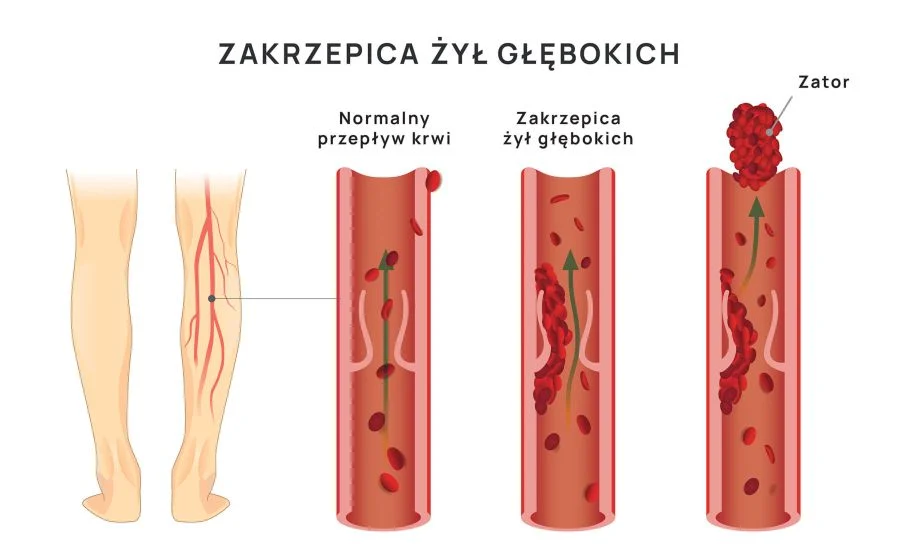
Zakrzepica żył głębokich
Do powstania zakrzepu w żyle prowadzą czynniki tzw. triady Virchowa. Należą do nich: zwolnienie przepływu krwi (np. w wyniku ucisku żyły lub unieruchomienia kończyny), przewaga czynników prozakrzepowych nad inhibitorami krzepnięcia i czynnikami fibrynolitycznymi (trombofilie wrodzone i nabyte), uszkodzenie ściany naczyniowej (np. w wyniku urazu lub mikrourazów w czasie operacji kończyny dolnej). Niestety objawy kliniczne zakrzepicy są mało swoiste. W żylnej chorobie zakrzepowo-zatorowej klasyczną triadę objawów klinicznych – obrzmienie, ból i zasinienie – stwierdza się tylko u około 10% chorych.
Powstanie choroby zakrzepowo-zatorowej determinują czynniki ryzyka, do których zaliczają się:
1. Cechy osobnicze i stany kliniczne:
- wiek >40 lat (ryzyko wzrasta wraz z wiekiem),
- otyłość BMI>30kg/m²,
- przebyta ŻCHZZ,
- urazy (zwłaszcza wielonarządowe lub złamania: miednicy, bliższego odcinka kości udowej i innych kości długich kończyn dolnych),
- niedowład kończyn dolnych,
- długotrwałe unieruchomienie,
- nowotwory złośliwe,
- ŻCHZZ w wywiadzie rodzinnym,
- trombofilie wrodzone lub nabyte,
- sepsa,
- obłożna choroba leczona zachowawczo np. ciężkie zapalenie płuc,
- niewydolność serca,
- niewydolność oddechowa,
- choroba Leśniowskiego-Crohna,
- zespół nerczycowy,
- nowotwory mieloproliferacyjne,
- nocna napadowa hemoglobinuria,
- ucisk na naczynia żylne spowodowany przez guz, krwiak,
- ciąża i połóg,
- długotrwały lot samolotem >6-8 godzin,
- żylaki kończyn dolnych u osób <60 roku życia.
2. Interwencje diagnostyczne, profilaktyczne i lecznicze w żylnej chorobie zakrzepowo-zatorowej:
- duże zabiegi operacyjne – szczególnie w obrębie miednicy i jamy brzusznej czy kończyn dolnych,
- obecność cewnika w dużych żyłach,
- leczenie przeciwnowotworowe,
- stosowanie doustnych środków antykoncepcyjnych, hormonalnej terapii zastępczej lub selektywnych modulatorów receptora estrogenowego,
- stosowanie leków stymulujących erytropoezę.
Część tych czynników ma charakter przemijający (np. urazy, operacje, unieruchomienie w gipsie), inne natomiast są trwałe (np. wrodzone trombofilie).
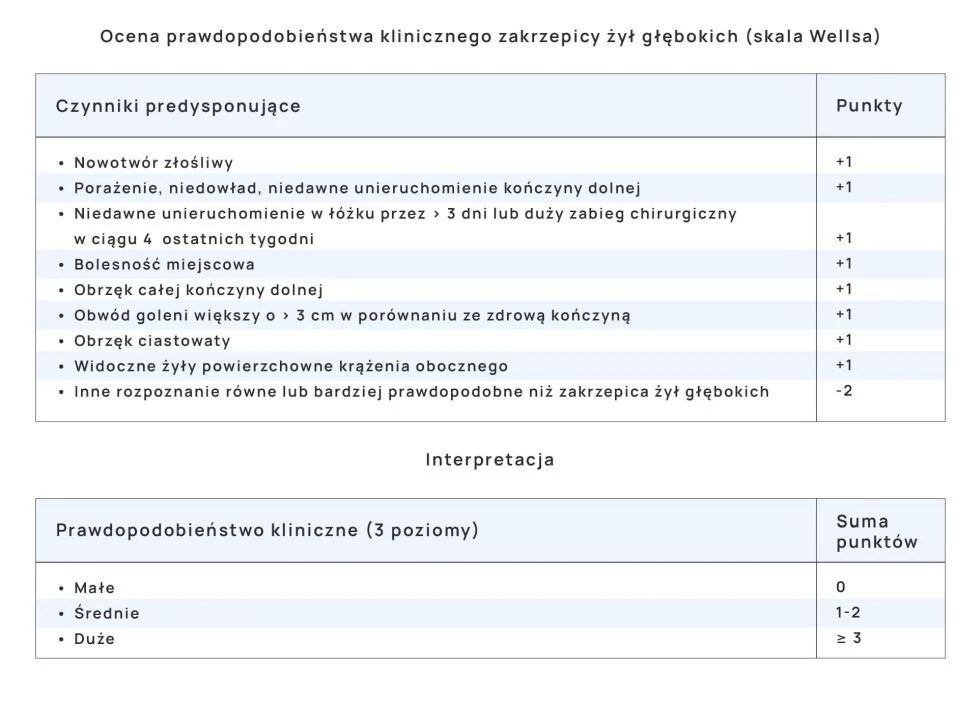
Postępowanie diagnostyczne zależy od zakwalifikowania pacjenta do grupy większego lub mniejszego ryzyka ŻCHZZ na podstawie punktacji uzyskanej np. w skali Wellsa.
Prawdopodobieństwo wystąpienia zakrzepicy żył głębokich
Zawsze należy dążyć do potwierdzenia lub wykluczenia rozpoznania ZŻG ze względu na duże ryzyko powikłań (w tym również zgonu) oraz konieczność długotrwałego leczenia przeciwkrzepliwego obarczonego ryzykiem poważnych skutków niepożądanych.
Zakrzepica żył głębokich – badania
Podstawą rozpoznania jest połączenie oceny klinicznego prawdopodobieństwa zakrzepicy żył głębokich np.za pomocą skali Wellsa z oznaczeniem stężenia D-dimerów i/lub USG.
D-dimer jest czułym wskaźnikiem odkładania i stabilizacji skrzepu fibrynowego, jego obecność w osoczu świadczy o aktywacji trombogenezy i degradacji fibynolitycznej powstającego skrzepu.
Stężenie D-dimeru w osoczu jest badaniem pomocniczym, ale o dużej wartości, ponieważ wynik ujemny (czyli wartość D-dimeru <500 µg/l) z dużym prawdopodobieństwem pozwala wykluczyć obecność żylnej choroby zakrzepowo-zatorowej. Z kolei zakrzepicy żylnej nie można niestety z całą pewnością rozpoznać, jeśli stężenie D-dimeru wynosi powyżej 500 µg/l, gdyż jego wzrost może być spowodowany między innymi zespołem rozsianego wykrzepiania wewnątrznaczyniowego DIC (disseminated intravascular coaqulation). Poziom D-dimeru jest również częściej podwyższony u pacjentów z nowotworem złośliwym, u osób hospitalizowanych, u osób z ciężką infekcją lub chorobą zapalną oraz w czasie ciąży. Ostrożnie należy interpretować prawidłowe stężenie D-dimeru u pacjentów, u których objawy ŻCHZZ trwają dłużej niż tydzień (po 1-2 tygodniach stężenie może się obniżyć do ¼ wartości wyjściowej).
Swoistość D-dimeru oznaczanego w razie podejrzenia żylnej chorobie zakrzepowo-zatorowej obniża się wraz z wiekiem i osiąga ~10% u chorych >80. roku życia. Posługiwanie się dostosowanymi do wieku wartościami odcięcia D-dimeru może zwiększyć przydatność oznaczania tego parametru u starszych chorych na ŻCHZZ. W międzynarodowym prospektywnym badaniu dotyczącym postępowania oceniono uprzednio walidowaną, dostosowaną do wieku wartość odcięcia D-dimeru jako (wiek × 10 µg/l u pacjentów >50. r.ż.).
Zatorowość płucna (ZP)
Zatorowość płucna powstaje w wyniku zamknięcia lub zwężenia tętnicy płucnej, lub części jej rozgałęzień przez materiał zatorowy, którym mogą być skrzepliny (najczęściej z żył głębokich kończyn dolnych lub miednicy mniejszej, rzadziej z żył górnej części ciała). Zatorowość płucna jest wówczas kliniczną manifestacją zakrzepicy żył głębokich. Czynniki ryzyka ZP to czynniki ryzyka ZŻG, ale w 1/3 przypadków nie udaje się ustalić takich czynników (w ZP samoistnej lub idiopatycznej).
Następstwem zatorowości płucnej (nasilenie zależy od masywności zatoru i indywidualnej rezerwy układu sercowo-naczyniowego) jest upośledzenie wymiany gazowej, hipoksemia (głównym następstwem hipoksemii jest niedotlenienie i kwasica tkanek), wzrost oporu naczyń płucnych, zwiększenie obciążenia prawej komory serca, zmniejszenie pojemności minutowej serca, hipotensja/wstrząs, upośledzenie przepływu wieńcowego, uszkodzenie mięśnia sercowego, zawał, często zgon.
Skala Wellsa służy również do oceny klinicznej prawdopodobieństwa wystąpienia zatorowości płucnej. Pozwala podjąć decyzję co do dalszego postępowania z chorym z podejrzeniem zatorowości płucnej- (wytyczne ESC z 2019 roku). Od oceny prawdopodobieństwa zatorowości płucnej zależy optymalne zaplanowanie diagnostyki, interpretacja wyników badań pomocniczych oraz decyzja o wdrożeniu leczenia jeszcze przed ukończeniem procesu diagnostycznego.
Prawdopodobieństwo wystąpienia zatorowości płucnej
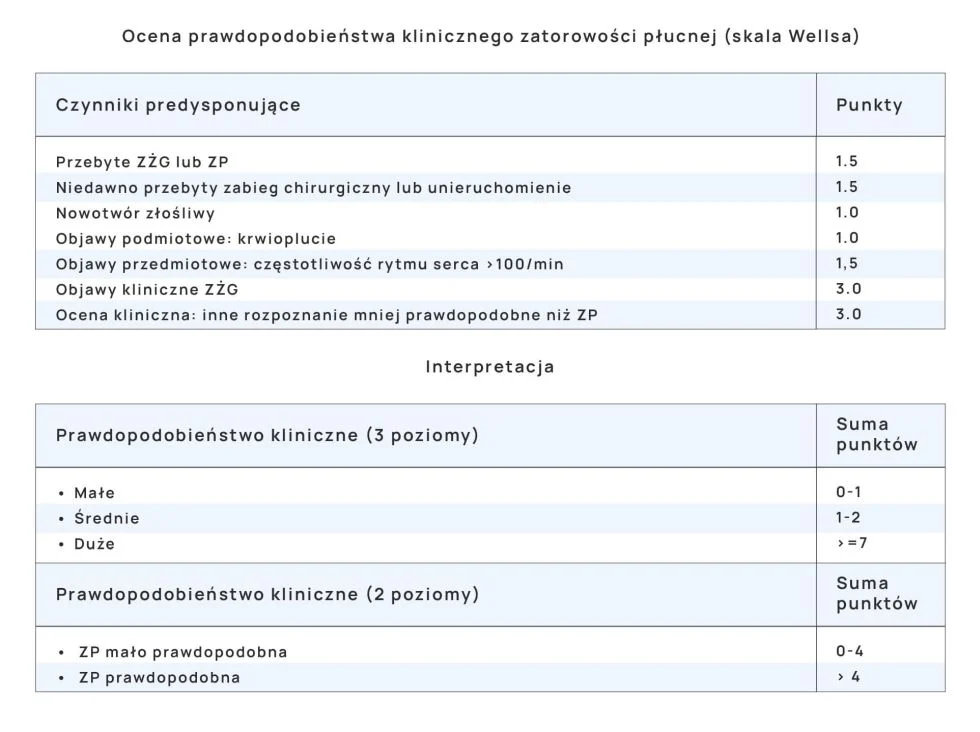
Chory z podejrzeniem zatorowości płucnej wymaga szybkiej diagnostyki. Strategia postępowania zależy od stanu chorego i możliwości diagnostycznych.
Żylna choroba zakrzepowo-zatorowa – badania
Badania pomocnicze – biomarkery laboratoryjne
Zaleca się oznaczenie stężenia D-dimeru w osoczu, u chorych ambulatoryjnych lub przebywających w oddziale ratunkowym, z małym lub pośrednim prawdopodobieństwem klinicznym albo z ZP mało prawdopodobną, w celu ograniczenia wykonywania niepotrzebnych badań obrazowych i ekspozycji na promieniowanie jonizujące. Jako alternatywę dla stałej wartości odcięcia stężenia D-dimeru w celu wykluczenia ZP należy rozważyć:
- U chorych z małym lub pośrednim prawdopodobieństwem klinicznym, lub z zatorowością płucną mało prawdopodobną – przyjęcie wartości odcięcia (dla wyniku ujemnego) dostosowanej do wieku (wiek × 10 µg/l u chorych w wieku >50 lat).
- Interpretację stężenia D-dimeru uzależnioną od klinicznego prawdopodobieństwa – wartości odcięcia dostosowuje się do prawdopodobieństwa klinicznego według modelu (3 kryteria kliniczne) opartym na algorytmie decyzyjnym YEARS: objawy ZŻG, krwioplucie i stwierdzenie, czy ZP jest najbardziej prawdopodobnym rozpoznaniem; zatorowość płucną wyklucza się u chorych bez spełnionych kryteriów klinicznych przy stężeniu D-dimeru <1000 µg/l, a u chorych spełniających ≥1 kryterium kliniczne – przy stężeniu <500 µg/l).
U chorych z dużym prawdopodobieństwem klinicznym nie zaleca się pomiaru D-dimeru, ponieważ prawidłowy wynik nie pozwala bezpiecznie wykluczyć ZP nawet w przypadku użycia testu o dużej czułości.
W przypadku niedrożności co najmniej 25% naczyń płucnych może rozwinąć się przeciążenie prawej komory serca. Natomiast niedrożność 75% tętniczego łożyska płucnego prowadzi do prawo-komorowej niewydolności serca, hipotensji i wstrząsu.
Stężenie biochemicznych wskaźników przeciążenia (peptydy natriuretyczne) i uszkodzenia prawej komory serca (troponiny sercowe) w surowicy krwi w ostrej zatorowości płucnej wysokiego ryzyka jest podwyższone.
Markery dysfunkcji prawej komory serca:
Przeciążenie ciśnieniowe prawej komory serca spowodowane ostrą zatorowością płucną wiąże się ze wzrostem napięcia ściany mięśnia sercowego, co prowadzi do uwolnienia peptydu natriuretycznego typu B (BNP) oraz N-końcowego fragmentu propeptydu natriuretycznego typu B (NT-proBNP).
Stężenia peptydów natriuretycznych odzwierciedlają stopień dysfunkcji prawej komory i zaburzenia hemodynamiczne w ostrej ZP. Badania wykazują, że około 51% pacjentów z ostrą zatorowością płucną miało podwyższone stężenia BNP lub NT-proBNP przy przyjęciu do szpitala; u tych chorych ryzyko wczesnego zgonu wynosiło 10%, a ryzyko poważnego niekorzystnego zdarzenia klinicznego – 23%.
Niskie poziomy BNP lub NT-proBNP wykazują wysoką czułość i negatywną wartość predykcyjną w aspekcie wykluczenia niekorzystnego wczesnego zdarzenia klinicznego.
Markery uszkodzenia mięśnia sercowego:
Podwyższone stężenia troponin w osoczu przy przyjęciu do szpitala mogą się wiązać z gorszym rokowaniem w ostrej fazie zatorowości płucnej. Wzrost troponiny I lub troponiny T definiuje się jako stężenie przekraczające jej prawidłowe zakresy. Spośród pacjentów z ostrą ZP podwyższone stężenia sercowej troponiny I lub T miało ok. 60% (przy użyciu testów wysokoczułych). Interpretowane w połączeniu z danymi klinicznymi oraz danymi pochodzącymi z badań obrazowych mogą ułatwić zarówno identyfikację chorych z grupy podwyższonego ryzyka związanego z zatorowością płucną, jak i dalszą stratyfikację ryzyka takich pacjentów.
Podwyższone stężenie kreatyniny w surowicy i obniżony (kalkulowany) wskaźnik filtracji kłębuszkowej oraz podwyższony poziom cystatyny-C mają również istotna wartość prognostyczną. Podobnie oznaczenia stężenia sodu (hiponatremia) i wazopresyny stanowią użyteczne narzędzie w stratyfikacji ryzyka chorych z ostrą zatorowością płucną.
Żylna choroba zakrzepowo zatorowa jest częstym powikłaniem u pacjentów leczonych na oddziałach zabiegowych i niezabiegowych. Około 30% chorych z zatorowością płucną ma również objawy zakrzepicy żył głębokich. Zakrzepica żył głębokich kończyn dolnych stanowi istotny czynnik ryzyka zatorowości płucnej (około 50%).
Przebycie żylnej choroby zakrzepowo-zatorowej zwiększa prawdopodobieństwo nawrotu choroby, szczególnie jeśli utrzymują się czynniki ryzyka (do 10% rocznie). Odpowiednio długie leczenie zmniejsza prawdopodobieństwa nawrotu choroby. Niestety u około 5% pacjentów po przebyciu ostrej postaci zatorowości płucnej rozwija się przewlekłe zakrzepowo- zatorowe nadciśnienie płucne, a u 30-50% pacjentów z objawową zakrzepicą żył głębokich kończyn dolnych rozwija się zespół pozakrzepowy (w 5- letniej obserwacji).