Spis treści
- EBV – co to za wirus?
- Mononukleoza – objawy
- Diagnostyka mononukleozy
- Główne grupy testów
- Kolejność pojawiania się poszczególnych przeciwciał podczas mononukleozy
- Diagnostyka molekularna mononukleozy
- Leczenie mononukleozy
EBV – co to za wirus?
Wirus Epsteina-Barra (EBV) jest ludzkim wirusem należącym do rodziny Herpesviridae znany również jako ludzki wirus opryszczki 4 (HHV-4), zakaża ponad 95% dorosłych osobników i utrzymuje się przez całe życie w zakażonym żywicielu. Zakażenie pierwotne zwykle przebiega bezobjawowo, ale może powodować mononukleozę zakaźną (IM- infectious mononucleosis), występującą najczęściej u dzieci i młodych dorosłych.
Wirus Epsteina-Barra (EBV) jest wirusem onkogennym, który może wywołać nowotwory nabłonkowe, takie jak rak nosogardła, ok. 10% przypadków raka żołądka, a także chłoniaki, w tym chłoniaka Burkitta, chłoniaka Hodgkina, chłoniaka rozlanego z dużych komórek B, chłoniaka z komórek NK/T i potransplantacyjny zespół limfoproliferacyjny. IM w wywiadzie wiąże się przede wszystkim ze wzrostem ryzyka zachorowania na chłoniaka Hodgkina i stwardnienie rozsiane (ostatnie doniesienia potwierdziły dowody na to, że wirus Epsteina-Barra (EBV) jest czynnikiem etiologicznym stwardnienia rozsianego).
Mononukleoza – objawy
Infekcje występujące we wczesnym dzieciństwie charakteryzują się najczęściej bardzo łagodnymi objawami lub zupełnym ich brakiem. Natomiast w okresie dojrzewania lub u młodych dorosłych często rozwijają się objawy mononukleozy zakaźnej. W typowym przebiegu IM początkowo (kilka dni do tygodnia) występują nieswoiste objawy – pacjenci skarżą się na zmęczenie, brak apetytu i/lub bóle mięśni. Po tym czasie występują kolejne objawy: gorączka 39-40°C (u 90% pacjentów), powiększenie szyjnych węzłów chłonnych (90%), rozlane wysiękowe zapalenie gardła (33%) i/lub wysypka (5%). U około połowy pacjentów stwierdza się splenomegalię, która zwykle pojawia się w drugim lub trzecim tygodniu choroby, powiększona może być również wątroba, ale zdarza się to rzadko. Choroba trwa zazwyczaj 2-3 tygodnie, ale zmęczenie może utrzymywać się jeszcze nawet przez kilka miesięcy.
W następstwie infekcji pierwotnej dochodzi do przejścia zakażenia w postać latentną, a rezerwuarem wirusa stają się komórki pamięci (limfocyty B). Może również dojść do reaktywacji zakażenia w późniejszym czasie (zakażenie to przebiega wtedy często subklinicznie).
Wirus ten nie jest bardzo zaraźliwy, przenosi się głównie ze śliną (choroba pocałunków). Osoby z infekcją utajoną mogą przenosić zakażenie, dlatego właściwie nie ma możliwości zapobiegania rozsiewowi. Rozpoznanie IM opiera się na objawach klinicznych, takich jak ból gardła, gorączka, powiększenie węzłów chłonnych i osłabienie, w połączeniu z wynikami badań laboratoryjnych.
Mononukleoza zakaźna (IM) jest zespołem wywoływanym głównie przez wirus Epsteina-Barr (EBV), chociaż inne czynniki zakaźne, w tym wirus cytomegalii (CMV), ludzki herpeswirus 6 (HHV-6), adenowirus, wirus opryszczki pospolitej, Streptococcus pyogenes i Toxoplasma gondii, są również uznawane za potencjalne czynniki etiologiczne. Spośród nich najczęstszym z nich jest CMV, który może być przyczyną nawet 7% przypadków zespołów mononukleozy. Metodą z wyboru w diagnostyce IM pozostaje serologia.
Diagnostyka mononukleozy
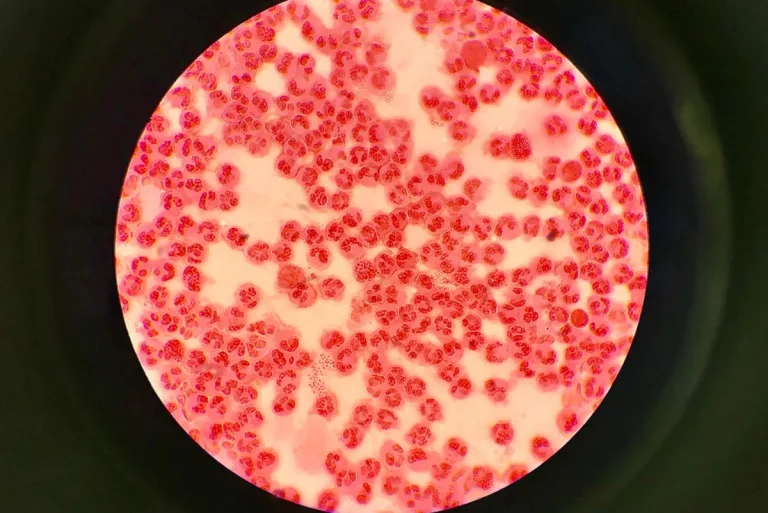
U większości pacjentów z niepowikłaną mononukleozą do diagnostyki w zupełności wystarczy wykonanie morfologii krwi obwodowej z mikroskopową oceną rozmazu i test na obecność przeciwciał heterofilnych. Na zakażenie wirusem Epsteina-Barra (EBV) może wskazywać obecność limfocytów reaktywnych wraz z bezwzględną limfocytozą.

Charakterystyczne wyniki morfologii krwi obwodowej u pacjentów zakażonych wirusem Epsteina-Barra (EBV):
- Reaktywne limfocyty
Już w pierwszym tygodniu choroby można zaobserwować wzrost całkowitej liczby krwinek białych z przewagą limfocytów (limfocyty są duże, z nieregularnym jądrem, stanowią co najmniej 10% wszystkich leukocytów. Są to aktywowane limfocyty T (CD8), powstałe w odpowiedzi na obecność w organizmie zakażonych limfocytów B
- Nieznaczna małopłytkowość 100-200tys/mm³(25-50% chorych)
- Nieswoisty obraz – leukopenia z granulocytopenią pierwsze dni po ustąpieniu objawów
Główne grupy testów
Testy nieswoiste
Odczyn Paula – Bunnella – Davidsohna:
Nieswoiste przeciwciała heterofilne (głównie IgM; odczyn Paula, Bunnella i Davidsohna, szybkie testy aglutynacyjne) – pomocne w razie niedostępności swoistych testów serologicznych; pojawiają się pod koniec 2. tyg. i w 3 tyg. choroby (u 80–90% dorosłych chorych) i dość szybko zanikają (nawet po upływie 1 miesiąca). W przypadku dodatniego wyniku dalsza diagnostyka nie jest zwykle konieczna (czułość ~75%, swoistość ~90%). U dzieci <12. r.ż. mogą nie występować, dlatego ujemny wynik testu nie wyklucza choroby, należy wtedy u nich poszukiwać przeciwciał swoistych.
Wykrywanie swoistych IgM, narzędzia z wyboru w przypadku większości zakażeń wirusowych, jest skomplikowane w przypadku zakażeń wirusem Epsteina-Barr (EBV) ze względu na wysoki stopień reakcji krzyżowej z innymi herpeswirusami powodującymi IM, takimi jak CMV i HHV-6 . Ponadto w przypadku IM poliklonalna stymulacja limfocytów pamięci może być odzwierciedlona jako dodatnia szeroka reaktywność IgM. W związku z tym potrzebne są profile przeciwciał do uzyskania skutecznej diagnostyki serologicznej zakażenia wirusem Epsteina-Barra (EBV). Głównymi markerami swoistymi dla wirusa są przeciwciała IgM i IgG w odpowiedzi na antygen kapsydu wirusa (VCA) oraz przeciwciała przeciwko antygenowi jądrowemu wirusa Epsteina-Barr (EBV) (EBNA), zgodnie z dobrze ustalonymi kryteriami.
Testy swoiste
- Przeciwciała skierowane przeciwko antygenowi kapsydowemu wirusa Epsteina-Barra (EBV) (viral capsid antigen – VCA)
- Przeciwciał skierowane przeciwko antygenowi wczesnemu (early antigen – EA)
- Przeciwciał skierowane przeciwko antygenowi jądrowemu (Epstein-Barr nuclear antigen – EBNA)


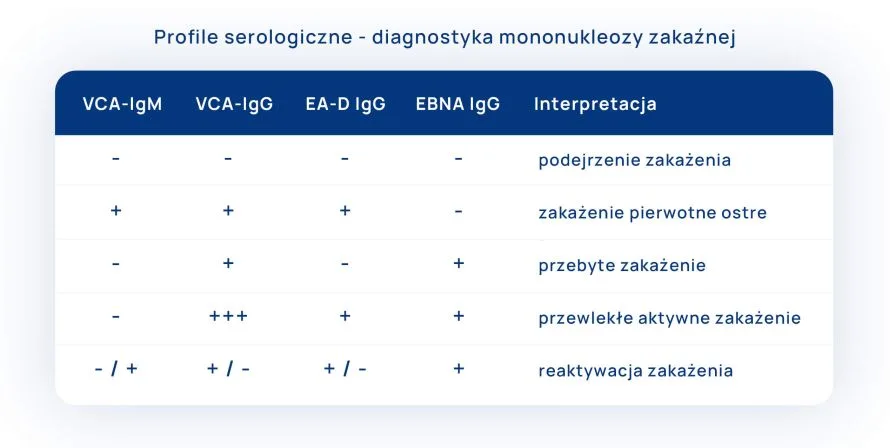
Kolejność pojawiania się poszczególnych przeciwciał podczas mononukleozy
Swoiste przeciwciała przeciwko wirusowi Epsteina-Barr (EBV) – pojawiają się w następującej kolejności:
- Anty – VCA IgM
- Anty – VCA IgG
- Anty – EA
- Anty – EBNA
Ad-1, Ad-2: przeciwko antygenowi kapsydowemu:
anty-VCA IgM – pojawiają się najwcześniej (w 2 tyg.), nawet u 95% ze świeżym zakażeniem, miano szybko się zwiększa w ciągu kilku dni od początku ostrej fazy zakażenia; zanikają w ciągu 2–3 mies.;
anty-VCA IgG – pojawiają 2-4 tyg od wystąpienia zakażenia wirusem Epsteina-Barra (EBV), w praktyce świadczą o przebytym zakażeniu (nie są przydatne do wykrywania ostrej fazy zakażenia), utrzymują się przez całe życie
Ad-3: przeciwko wczesnemu antygenowi:
anty-EA – pojawiają się w ostrej fazie zakażenia, zwykle są niewykrywalne po upływie 3–6 mies. (u ~20% zakażonych mogą być wykrywalne przez kilka lat od zakażenia)
Ad-4: przeciwko antygenom jądrowym:
anty-EBNA – wytwarzane później, po kilku tygodniach (3–6), a nawet kilku miesiącach po ostrej fazie zakażenia; świadczą o przebytym zakażeniu; utrzymują się przez całe życie
Diagnostyka molekularna mononukleozy
Metody molekularne znacznie poszerzają możliwości diagnostyczne zakażeń wirusem Epsteina-Barra (EBV), szczególnie u osób w immunosupresji i chorych na nowotwory. Stosowane są różne techniki molekularne wykrywające materiał genetyczny wirusa: hybrydyzacja in situ, PCR i PCR w czasie rzeczywistym. Metody te pozwalają zarówno na wykrycie materiału genetycznego wirusa, w zakażonych komórkach, jak i na monitorowanie jego ilości. Dzięki hybrydyzacji in situ genom wirusa Epsteina-Barra (EBV) wykryto między innymi w komórkach Reeda- Sternberga i komórkach Hodgkina.
Leczenie mononukleozy
Leczenie mononukleozy ma charakter objawowy. Zalecane jest leżenie w łóżku, przyjmowanie leków przeciwgorączkowych, przeciwbólowych/przeciwzapalnych, przyjmowanie większej ilość płynów (szczególnie wysoko gorączkującym). Dieta w okresie ostrym powinna być lekkostrawna, białkowo-węglowodanowa, bogata w witaminy. W ciągu miesiąca od początku choroby zaleca się również zmniejszenie aktywność fizycznej, przede wszystkim unikanie sportów kontaktowych (zapobieganie pęknięciu powiększonej śledziony).
W większości przypadków choroba ustępuje samoistnie po 3-4 tygodniach. Ciężki, powikłany przebieg wymaga leczenia szpitalnego.
Główne konsekwencje kliniczne zakażenia wirusem Epsteina-Barr (EBV) to:
- mononukleoza zakaźna,
- chłoniak Burkita,
- potransplantacyjny zespół limfoproliferacyjny.