Tasiemczyce są chorobami pasożytniczymi przewodu pokarmowego wywoływanymi przez robaki płaskie. Do zarażenia dochodzi drogą pokarmową na skutek spożycia surowego mięsa zawierającego wągry tasiemców lub spożycia pokarmu skażonego jajami pasożytów. Zarażenie jest zazwyczaj bezobjawowe, ale jego konsekwencją mogą być również uciążliwe dolegliwości oraz groźne dla ludzi powikłania zdrowotne.
Spis treści:
- Czym są tasiemce i jakie choroby wywołują?
- Jak można zarazić się tasiemcem? Przyczyny choroby
- Jakie są objawy tasiemczycy u człowieka?
- W jaki sposób można wykryć obecność tasiemca w organizmie?
- Jak przebiega leczenie tasiemczycy?
Czym są tasiemce i jakie choroby wywołują?
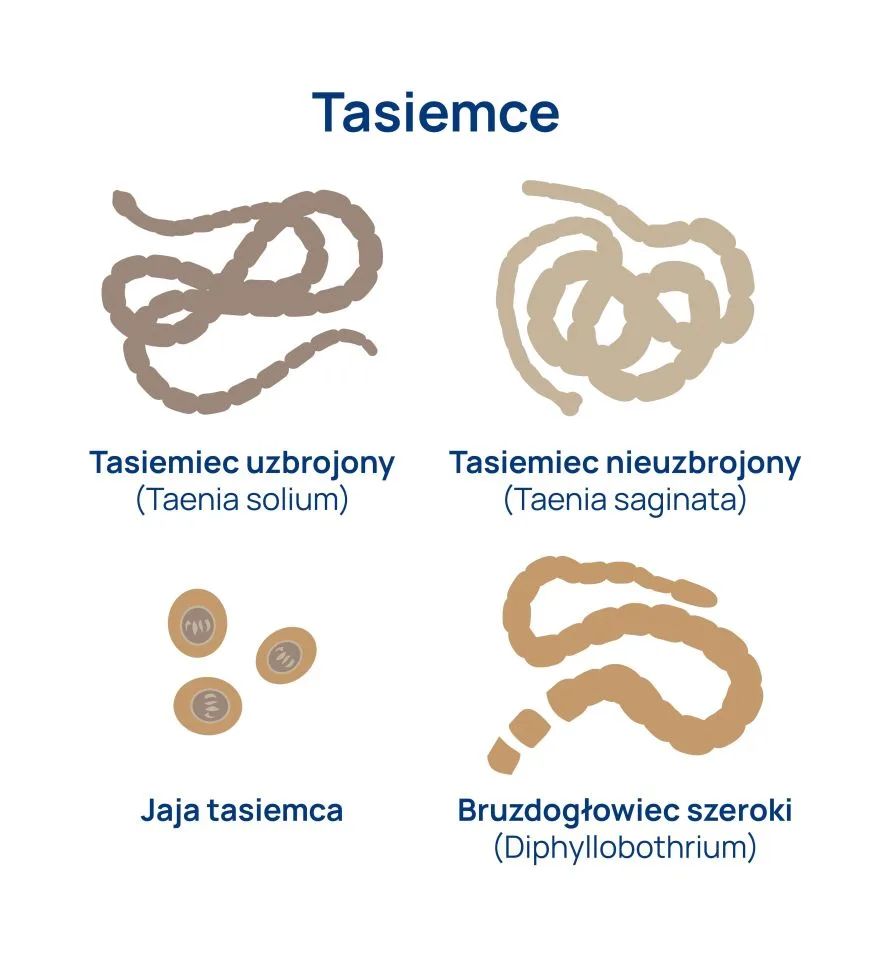
Tasiemce są pasożytami należącymi do robaków płaskich. Ciało robaków składa się z główki (skoleks) i członów (proglotydy) tworzących łańcuch (strobila). Najstarsze człony, wypełnione jajami, znajdują się na końcu „taśmopodobnego” ciała i noszą nazwę macicznych. Budowa główki i struktura członów są charakterystyczne dla poszczególnych gatunków tasiemców, co jest wykorzystywane do ich różnicowania.
Tasiemce nie mają przewodu pokarmowego – pokarm z jelita gospodarza wchłaniają całą powierzchnią ciała. Nie posiadają również układu krążenia ani układu oddechowego. Najlepiej rozwiniętym układem robaków jest układ rozrodczy. Tasiemce są hermafrodytami – ich narządy rozrodcze męskie i żeńskie znajdują się w każdym członie ciała.
Tasiemczyce (taeniasis) są chorobami przewodu pokarmowego wywoływanymi przez obecność w jelicie cienkim człowieka dojrzałej postaci tasiemców. Choroba wywołana przez larwy tasiemca nosi nazwę wągrzycy (cysticerkozy). Najczęściej u ludzi występują: tasiemiec nieuzbrojony (Taenia saginata), tasiemiec uzbrojony (Taenia solium), tasiemiec karłowaty (Hymenolepis nana) oraz sporadycznie bruzdogłowiec szeroki (Diphyllobotrium latum). Tasiemiec nieuzbrojony osiąga 10 m długości, tasiemiec uzbrojony 2-3 m, bruzdogłowiec szeroki 15 m, a najmniejszy z nich tasiemiec karłowaty – 15-40 mm.
Rozwój tasiemców przebiega z udziałem żywicieli pośrednich, którymi są zazwyczaj kręgowce. Cykl rozwojowy tasiemców obejmuje:
- stadium jaja – jaja tasiemca wydalane są wraz z odchodami człowieka do środowiska zewnętrznego, gdzie może dojść do ich spożycia przez zwierzęta (rzadziej człowieka) będące żywicielami pośrednimi.
- stadium larwy – na skutek spożycia jaj tasiemców w przewodzie pokarmowym żywicieli pośrednich uwalniają się larwy, które przemieszczają się do różnych narządów i mięśni, gdzie osiadają przekształcając się w formę przetrwalnikową – wągry. Wągry są postacią inwazyjną dla człowieka.
- postać dorosłą – w przewodzie pokarmowym człowieka (żywiciela ostatecznego) wągry przekształcają w postać dojrzałego tasiemca produkującą jaja.
Cykle rozwojowe poszczególnych gatunków tasiemców różnią się między sobą.
Problem tasiemczyc występuje na całym świecie. Szacuje się, że dotyczy to ok. 80 mln ludzi. Na Bliskim Wschodzie, w Afryce i Ameryce Południowej najczęściej spotykany jest tasiemiec nieuzbrojony. Bruzdogłowiec szeroki występuje endemicznie w Skandynawii, Ameryce Północnej, Rosji, Europie Wschodniej, Ugandzie i Chile. W Polsce odnotowuje się rocznie ok. 200 przypadków tasiemczyc oraz kilka przypadków wągrzycy.
>> Przeczytaj: Higiena rąk – jak skutecznie myć ręce?
Jak można zarazić się tasiemcem? Przyczyny choroby
Rezerwuarem tasiemców są ludzie. Do zarażenia dochodzi drogą pokarmową. W przypadku tasiemca uzbrojonego i nieuzbrojonego w organizmie człowieka bytuje zazwyczaj jeden osobnik, z kolei zarażenia tasiemcem karłowatym są zazwyczaj mnogie.
Tasiemiec nieuzbrojony (Taenia saginata)
Człowiek jest wyłącznie żywicielem ostatecznym tasiemca nieuzbrojonego, żywicielem pośrednim jest bydło. Jaja tasiemca, od chwili przedostania się do środowiska zewnętrznego, wykazują zdolność zarażania bydła przez 2 miesiące. Do zarażenia człowieka dochodzi poprzez spożywanie surowego mięsa wołowego zawierającego wągry (np. tartara). Larwy giną po 5 min w temperaturze 70°C i po 24 h w temperaturze -3°C.
Tasiemiec uzbrojony (Taenia solium)
Człowiek jest żywicielem ostatecznym tasiemca uzbrojonego. Żywicielem pośrednim są przede wszystkim świnie i dziki. Do zarażenia człowieka dochodzi poprzez spożywanie surowego mięsa wieprzowego lub dziczyzny zawierającego wągry. Larwy giną po 5 min w temperaturze 60-70°C i po 4 dniach w temperaturze -3°C.
W cyklu rozwojowym tasiemca uzbrojonego człowiek może być również żywicielem pośrednim. W tym przypadku zarażenie może być następstwem spożycia pokarmów zanieczyszczonych odchodami ludzi lub zwierząt. Może to być również skutkiem autoinwazji, kiedy człony tasiemca zawierające jaja przedostają się z jelita cienkiego człowieka do żołądka, gdzie uwalniane są larwy. Jaja tasiemca uzbrojonego wykazują zdolność zarażania przez 1-4 miesiące (w tuszy wieprzowej ok. 42 dni).
Bruzdogłowiec szeroki (Diphyllobotrium latum)
Cykl rozwojowy bruzdogłowca szerokiego obejmuje człowieka, jako żywiciela ostatecznego, oraz dwóch żywicieli pośrednich. Pierwszym żywicielem pośrednim są drobne skorupiaki z rodzaju Cyclops. Drugim – ryby słodkowodne (pstrąg, szczupak, łosoś, okoń). W cyklu rozwojowym tasiemca występują trzy rodzaje larw, które rozwijają się kolejno w wodzie (koracidium), skorupiakach (procerkoid) i rybach (plerocerkoid). Do zarażenia człowieka dochodzi poprzez spożycie surowego lub wędzonego mięsa ryb zawierających żywe larwy. Plerocerkoidy giną po 10 min gotowania, w temperaturze -10°C giną po 24 godzinach.
Tasiemiec karłowaty (Hymenolepis nana)
Człowiek może być jednocześnie żywicielem ostatecznym i pośrednim tasiemca karłowatego. Do zarażenia dochodzi poprzez spożycie żywności skażonej jajami tasiemca, poprzez brudne ręce lub przypadkowe połknięcie owada, w którym rozwinęła się forma przetrwalna (cysticercoid). Możliwe jest też samozarażenie. W tej sytuacji dochodzi do uwolnienia larw i rozwoju tasiemca w błonie śluzowej jelita. Zarażenia tasiemcem karłowatym są powszechne w krajach rozwijających się i wśród osób żyjących w złych warunkach sanitarno-higienicznych w zbiorowiskach ludzkich (domy opieki, internaty).
Jakie są objawy tasiemczycy u człowieka?
Okres od zarażenia człowieka do pojawienia się jaj tasiemca w kale jest różny dla poszczególnych gatunków i wynosi:
- dla tasiemca nieuzbrojonego i tasiemiec uzbrojonego – 10–14 tyg.
- dla bruzdogłowca szerokiego – 3–6 tyg.
- dla tasiemca karłowatego – 2 tyg.
Zarażenie tasiemcem jest zazwyczaj bezobjawowe lub z niezbyt nasilonymi zaburzeniami żołądkowo-jelitowymi. Czasami pierwszym dowodem świadczącym o zarażeniu tasiemcem nieuzbrojonym jest obecność na bieliźnie członów pasożyta, które u tego gatunku mogą wydostawać się poza odbyt człowieka w sposób aktywny. Człony tasiemca uzbrojonego są wydalane z organizmu wyłącznie biernie w trakcie wypróżniania.
Objawy kliniczne tasiemczycy mogą pojawić się po upływie kilku miesięcy do kilkunastu lat od momentu zarażenia. W przebiegu choroby pojawiają się bóle brzucha, przewlekła niestrawność, nudności, biegunka, obserwowana jest utrata wagi, oznaki niedożywienia. Symptomami zarażenia mogą być również reakcje alergiczne, drażliwość, brak skupienia, zaburzenia snu. Objawy związane są z mechanicznym uszkodzeniem błony śluzowej jelita oraz zatruciami przez produkty przemiany materii i rozpadu pasożytów.
Zarażenie bruzdogłowcem szerokim może prowadzić dodatkowo do niedokrwistości spowodowanej niedoborem witaminy B12 na skutek jej wchłaniania przez tasiemca. W przypadku zarażenia tasiemcem karłowatym zaobserwowano opóźnienie rozwoju intelektualnego u dzieci.
>> Sprawdź: Kiedy podejrzewać infekcję pasożytniczą u dziecka?
Niebezpieczną postacią zarażenia tasiemcem uzbrojonym jest wągrzyca (cysticerkoza), do której dochodzi na skutek spożycia pokarmów skażonych jajami pasożyta przez lub w wyniku autoinwazji. Formy przetrwalne tasiemca (wągry) mogą umiejscawiać się w mięśniach, tkance łącznej, płucach i oczach. Umiejscowienie wągrów w mózgu może prowadzić do wodogłowia, zapalenia opon mózgowo-rdzeniowych, ataków padaczkowych, nadmiernych odruchów, zaburzeń osobowości. Umiejscowienie w oku może z kolei prowadzić do utraty ostrości wzroku i zaburzenia pola widzenia.
W jaki sposób można wykryć obecność tasiemca w organizmie?
Obecność tasiemca w organizmie potwierdza się makroskopowym i mikroskopowym badaniem kału, w którym poszukuje się członów i/lub jaj pasożyta. Ze względu na okresowe uwalnianie jaj konieczne jest kilkukrotne wykonanie badania. Jaja tasiemca uzbrojonego i nieuzbrojonego są morfologicznie identyczne – ich różnicowanie do gatunku opiera się na odmiennej budowie członów macicznych.
W przypadku wykrycia zakażenia tasiemcem uzbrojonym należy przeprowadzić diagnostykę w kierunku wągrzycy. Rozpoznanie wągrzycy jest trudne i wymaga wykonania szeregu badań, w tym badań serologicznych w kierunku swoistych przeciwciał w klasie IgG przeciwko Taenia solium, badań histopatologicznych, badań obrazowych (tomografia komputerowa, rezonans magnetyczny), okulistycznych, a także badań krwi (w krwi obwodowej obserwuje się eozynofilię) i płynu mózgowo-rdzeniowego.

Jak przebiega leczenie tasiemczycy?
Przy szybkim rozpoznaniu tasiemczycy i wdrożeniu leków przeciwko pasożytom rokowania są pomyślne. W terapii stosuje się preparaty przeciwpasożytnicze przepisywane przez lekarza. Lekiem pierwszego wyboru jest prazykwantel, zaś lekiem drugiego wyboru – niklozamid. Leczenie podlega monitorowaniu. Przez trzy kolejne dni kał jest badany w celu określenia gatunku tasiemca oraz stwierdzenia wydalenia główki. Skuteczność terapii sprawdza się badaniem mikroskopowym po upływie jednego i trzech miesięcy.
Wybór leczenia wągrzycy zależy od umiejscowienia i liczby wągrów. Stosowane jest leczenie przeciwpasożytnicze lub operacyjne oraz leczenie objawowe. Leczenie podlega monitorowaniu, a częstotliwość wykonywanych badań kontrolnych jest zależna od przypadku.

Źródła:
- Tomasz Mach – „Tasiemczyce”; Interna Szczeklika 2020
- Tomasz Mach, Szymon Nowak, Jerzy Stefaniak „Tasiemczyce” https://www.mp.pl/interna/chapter/B16.II.4.24.4.5. (dostęp 30.04.2024 r.)
- Patric R. Murray, K.S. Rozenthal, M.A.Pfaller – „Mikrobiologia” wyd.VI; Wrocław 2011
- Gastroenterologia Praktyczna „Tasiemczyce (taenioses)” https://gastroenterologia-praktyczna.pl/a2590/Tasiemczyce–taenioses (dostęp 01.05.2024 r.)
- Zbigniew Anusz „Mikrobiologia i parazytologia lekarska”; PZWL 1990
- Meldunki o zachorowaniach na choroby zakaźne, zakażeniach i zatruciach w Polsce Narodowy Instytut Zdrowia Publicznego PZH PIB
- Wągrzyca (cysticerkoza) https://www.mp.pl/interna/chapter/B01.XI.F.3. (dostęp 30.04.2024 r.)