Spis treści
- Co to jest biomarker?
- Ferrytyna – funkcje i znaczenie
- Kiedy może występować podwyższony poziom ferrytyny?
- Ferrytyna a stłuszczeniowa choroba wątroby związana z dysfunkcją metaboliczną (MASLD)
Co to jest biomarker?
Termin biomarker jest stosunkowo nowy w słowniku pojęć medycznych. W 2001 r. National Institute of Health wprowadził wystandaryzowane pojęcie biomarkera: jest to cecha, która daje się obiektywnie zmierzyć i może być zastosowana w ocenie fizjologicznych procesów biologicznych, procesów patologicznych, lub odpowiedzi organizmu na działania terapeutyczne. Każdy biomarker, zanim zostanie zastosowany w praktyce klinicznej, powinien zostać oceniony według trzech kryteriów:
- czy w praktyce klinicznej istnieje dostęp do wiarygodnych oznaczeń,
- czy na podstawie wyniku testu otrzymuje się dodatkowe informacje,
- czy wynik testu implikuje postępowanie z chorym.
Co w praktyce oznacza, że dany test musi być wiarygodny, powtarzalny, szeroko dostępny, szybki, względnie tani, a wynik musi przekładać się na decyzje kliniczne.
Ferrytyna – funkcje i znaczenie
Oznaczenie stężenia ferrytyny we krwi należy obecnie do badań wykonywanych rutynowo. W praktyce klinicznej często pojawiają się podwyższone wartości stężenia ferrytyny, które za każdym razem wymagają krytycznej interpretacji, mogą one bowiem u różnych chorych oznaczać obecność odmiennych procesów chorobowych. Przyjmuje się, że stężenie ferrytyny świadczy o wielkości ustrojowych zasobów żelaza, lecz interpretacja jej podwyższonych wartości dalece wykracza poza rolę wskaźnika przepełnienia tkankowych magazynów żelaza. Badania wskazują, że u około 10% osób z hiperferrytynemią udaje się potwierdzić wrodzoną hemochromatozę. Zatem ocena podwyższonych wartości ferrytyny wymaga przeprowadzenia wnikliwego wywiadu w kierunku chorób występujących rodzinnie oraz współistniejących schorzeń, a także wykonania szeregu badań laboratoryjnych oceniających stan gospodarki żelazem.
Żelazo jest niezbędnym pierwiastkiem do życia, ale może być również toksyczne dla komórek. Obecność wolnych atomów żelaza powoduje stres oksydacyjny i apoptozę komórek oraz odpowiada za rozrost macierzy łącznotkankowej. Cząsteczką, która wiąże w bezpieczny dla komórek sposób atomy żelaza, jest właśnie ferrytyna.
Oprócz magazynowania żelaza istotne mogą być jej właściwości oksydoredukcyjne, gdzie atomy żelaza umożliwiają wychwytywanie wolnych rodników (w procesie tym żelazo jest utleniane ze stopnia 2+ do 3+). Ta właściwość wyjaśnia wzrost stężenia ferrytyny w przypadku pojawienia się stanu zapalnego, któremu towarzyszy stres oksydacyjny. Wykryto również gen odpowiedzialny za transkrypcję ferrytyny, który jest pobudzany pod wpływem stresu oksydacyjnego w warunkach stanu zapalnego.

Kiedy może występować podwyższony poziom ferrytyny?
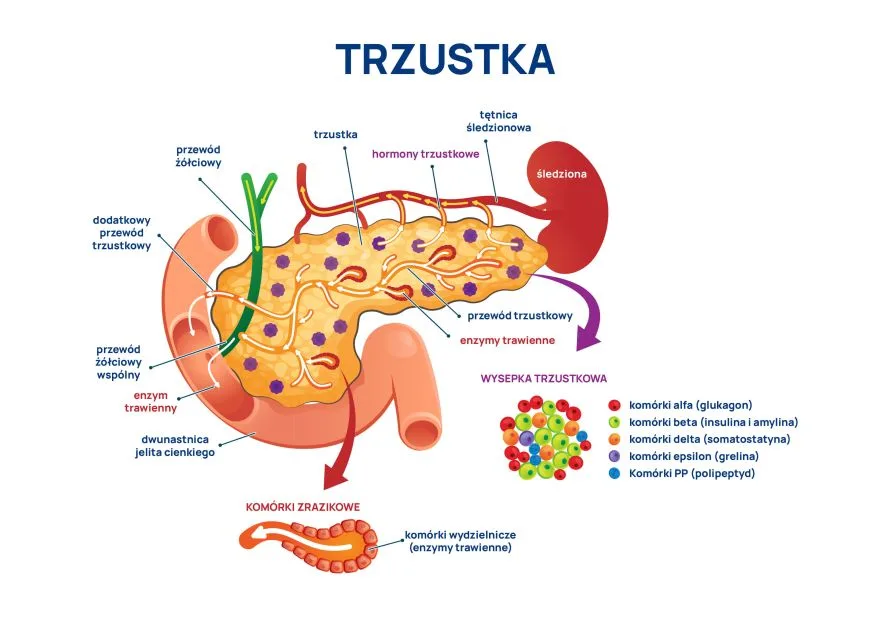
Stan zapalny powoduje wzrost ekspresji podjednostki H ferrytyny, która dzięki centrom ferroksydazowym ma zdolność sekwestracji żelaza i ochrony przed stresem oksydacyjnym. Konsekwencją tego zjawiska jest deficyt dostępnego żelaza i niedokrwistość obserwowana w przewlekłych stanach zapalnych. Podjednostka H przeważa w komórkach wymagających wysokiej dostępności żelaza, takich jak erytrocyty oraz komórki mięśnia sercowego. W narządach magazynujących żelazo, takich jak wątroba i śledziona, ferrytyna zbudowana jest głównie z podjednostki L, niezawierającej centrów ferroksydazowych, której główną rolą jest przechowywanie w formie biodostępnej atomów żelaza.
W warunkach fizjologicznych podjednostka H nie jest wydzielana do krwi, a obecna we krwi jest wyłącznie forma glikozydowa podjednostki L. Bardzo wysokie stężenia we krwi podjednostki L występują w zespole wrodzonej hiperferrytynemii ‑ zaćmy (HHCS), dziedziczącej się autosomalnie dominująco. Choroba ta jest spowodowana upośledzeniem ujemnego sprzężenia zwrotnego pomiędzy wewnątrzkomórkowym stężeniem żelaza a syntezą L‑ferrytyny z powodu mutacji białka regulatorowego IRE (iron responsive protein). W tych warunkach występuje brak hamowania translacji ferrytyny L, której transkrypcja staje się niezależna od stężenia żelaza w organizmie oraz od białek regulatorowych, dlatego wysokie stężenie ferrytyny utrzymuje się nawet w przypadku niedoborów żelaza. Jedyną manifestacją kliniczną tej choroby jest obuoczna zaćma, występująca z reguły przed 35. r.ż.
Podwyższone stężenie ferrytyny, ale ze zwiększoną saturacją transferyny występuje natomiast w zespołach przeciążenia żelazem. Saturacja transferyny powyżej 60% u mężczyzn oraz powyżej 50% u kobiet wykazuje ponad 90% czułości w wykrywaniu hemochromatozy typu I, (warunkiem jest zwiększona aktywność enzymów wątrobowych).
Objawami zespołów przeciążeniowych są:
- uszkodzenie wątroby,
- bóle stawów,
- uszkodzenie serca,
- hipogonadyzm,
- cukrzyca,
- brązowa pigmentacja skóry.
Wyróżnia się kilka podtypów genetycznie uwarunkowanej hemochromatozy: hemochromatozę typu 1 (HFE hemochromatoza), typu 2 (hemochromatoza młodzieńcza), typu 3 (defekt receptora transferyny), typu 4 (choroba ferroportynowa) z podtypem 4a charakteryzującym się niską saturacją transferyny oraz podtypem 4b z podwyższoną wartością tego wskaźnika, typu 5 (niedobór lub brak transferyny) oraz typu 6 (aceruloplazminemia). Natomiast najczęstszą przyczyną hiperferrytynemii z prawidłowym wskaźnikiem saturacji transferyny jest dysmetaboliczny zespół przeciążenia żelazem. Wśród innych przyczyn należy wymienić alkoholowe zapalenie wątroby, przewlekłe wirusowe zapalenie wątroby typu B i C, choroby nowotworowe, choroby autoimmunologiczne, jak reumatoidalne zapalenie stawów, toczeń trzewny, choroba Stilla lub zespół aktywacji makrofagów oraz liczne przetoczenia krwi z powodu niedokrwistości bądź nadmierną suplementację żelaza. Wysokie stężenia ferrytyny (ponad 1000 ng/ml) są często związane z ciężką chorobą wątroby, zwykle w stadium marskości. W takich przypadkach wskazana jest ocena histopatologiczna wątroby z jakościową lub ilościową oceną stężenia żelaza w tym narządzie.
Ostatnie doniesienia międzynarodowej grupy badaczy wskazują, że ferrytyna może służyć również do monitorowania stłuszczeniowej choroby wątroby związanej z dysfunkcją metaboliczną – MASLD.
>>> Przeczytaj też: Ferrytyna – możliwe przyczyny hiperferrytynemii
Ferrytyna a stłuszczeniowa choroba wątroby związana z dysfunkcją metaboliczną (MASLD)
Zespół metaboliczny, niestety obecnie bardzo częsty w populacji krajów wysoko rozwiniętych, powoduje wiele konsekwencji zdrowotnych. Jedną z nich jest dysfunkcja wątroby (nazwa i definicja nieco się zmieniają, jednak istota zaburzenia jest niezmienna). Najnowszym określeniem jest stłuszczeniowa choroba wątroby związana z dysfunkcją metaboliczną (MASLD). Szacuje się, że dotyka nawet 30% dorosłej populacji na całym świecie, a częstość występowania wzrosła z 22 do 37% tylko w latach 1991–2019. Podstawą leczenia jest zmiana trybu życia, jednak wobec braku leków selektywnych równie ważne jest monitorowanie ryzyka powikłań choroby, a tu – także długofalowo – pomocna może być ferrytyna, a przekonują o tym dowody zaprezentowane na łamach „The Gut”.
Międzynarodowy zespół badaczy ocenił związek między wyjściowym stężeniem ferrytyny w surowicy a różnego rodzaju powikłaniami w przebiegu stłuszczeniowej choroby wątroby związanej z dysfunkcją metaboliczną (MASLD) wśród 1342-osobowej populacji pozostających pod opieką wielu różnych europejskich ośrodków w czasie 4 – 5 lat. Powikłania w przebiegu dysfunkcji narządu takie jak np. żylaki przełyku i/lub krwawienie, wodobrzusze, samoistne bakteryjne zapalenie otrzewnej, encefalopatia wątrobowa, żółtaczka wystąpiły u 7,7% badanej populacji, rak wątrobowokomórkowy 1,9%, incydenty sercowo-naczyniowe 10,9%, nowotwory pozawątrobowe u 8,3%, a śmiertelność ogólna sięgnęła 6%. Obliczono, że utrzymująca się w ocenianym czasie hiperferrytynemia była związana z 50% zwiększeniem ryzyka tych powikłań i 27% śmiertelnością z jakiejkolwiek przyczyny. Ryzyko wystąpienia powikłań rosło głównie od progu 215,5 µg/l, a zgonu z jakiejkolwiek przyczyny od 272 µg/l.
Według autorów badanie to potwierdza potencjalne wykorzystanie stężenia ferrytyny w surowicy do przewidywania długoterminowego rokowania pacjentów ze stłuszczeniową chorobą wątroby związaną z dysfunkcją metaboliczną (MASLD).
>>> Przeczytaj też: Hemochromatoza – najczęstsza choroba rzadka. Diagnostyka, objawy, leczenie
Piśmiennictwo
- Armandi A. .and….; Division of Gastroenterology and Hepatology,: Serum ferritin levels can predict long-term outcomes in patients with metabolic dysfunction-associated steatotic liver disease; gutjnl-2023-330815B; Hepatology;
- Kosiorowska E., Hartleb M.: Ferrytyna strategia diagnostyczna dla wysokich stężeń osoczowych, gastroenterologia prakryczna, 2016, 4(33).