Spis treści
- Karnityna – rola w organizmie
- Karnityna – źródła i zapotrzebowanie
- Czy karnityna wspomaga odchudzanie?
Karnityna jest związkiem organicznym, który został odkryty w roku 1905 w mięśniach i stąd wzięła się jej nazwa (caro,carnus po łacinie oznacza ciało, mięso). Dwadzieścia dwa lata później (w 1927 roku) opisano budowę chemiczną tego związku, lata 1935-1965 to okres odkrywania jej funkcji w organizmie.
Karnityna jest popularnym suplementem, ponieważ ma wspomagać odchudzanie. Takie działanie karnityny ma podstawy teoretyczne, ale czy znajduje potwierdzenie w badaniach i czy warto ją suplementować? Postaramy się odpowiedzieć w tym artykule.
Karnityna – rola w organizmie
Karnityna to dwa izomery (L-karnityna i D-karnityna) oraz acetylo-L-karnityna, propionylo-L-karnityna i winian L-karnityny. Z dwóch izomerów karnityny aktywność biologiczną wykazuje L-karnityna i na tym związku skupi się artykuł.
Natomiast acetylo-L-karnityna jest substancją, która przenika przez barierę krew-mózg i ma poprawiać funkcje mózgu. Ma być również ważnym źródłem energii podtrzymującym ruchliwość plemników.
Podstawowa rola karnityny to udział w transporcie długołańcuchowych kwasów tłuszczowych przez wewnętrzną błonę mitochondrialną, gdzie są wykorzystywane do produkcji energii w postaci ATP. Proces jest szczególnie aktywny w mięśniach, w tym również w mięśniu sercowym.
Krótkołańcuchowe kwasy tłuszczowe są utlenianie w mitochondriach niezależnie od karnityny, jednak WKT (w tym omega-3 i omega-6) nie mogą przenikać przez wewnętrzną błonę mitochondrialną, jeśli nie utworzą związku o nazwie acylokarnityna, która przez tę błonę może przenikać. Proces jest zależy od wielu enzymów i – co jest ważne dla dalszych rozważań – warunkuje działanie karnityny, które jest możliwe w strukturach wewnętrznych komórek.
Karnityna wspomaga również proces transportu niektórych związków toksycznych z wnętrza mitochondriów na zewnątrz.
Karnityna – źródła i zapotrzebowanie
Karnityna to związek, który organizm człowieka pozyskuje z dwóch źródeł: syntezy endogennej i diety.
Proces syntezy endogennej to połączenie dwóch aminokwasów, lizyny i metioniny. Obydwa związki należą do tzw. aminokwasów egzogennych, czyli takich, których nasz organizm nie wytwarza i muszą być dostarczone z dietą. Odpowiednia ilość lizyny i metioniny w pokarmie jest warunkiem koniecznym do prawidłowej syntezy karnityny. Sam proces powstawania karnityny ma miejsce w wątrobie i nerkach.
Badania wskazują jednak, iż endogenna synteza karnityny to 15% ilości karnityny obecnej w organizmie. Pozostałe 75% jest dostarczane z dietą.
Jakie są pokarmowe źródła karnityny?
Karnityna występuje przede wszystkim w produktach pochodzenia zwierzęcego, w tym w czerwonym mięsie. Można ją znaleźć w baraninie, wołowinie i wieprzowinie. Mniejsze ilości dostępne są w rybach i drobiu oraz przetworach mlecznych. Znikome ilości zawarte są w warzywach i owocach.
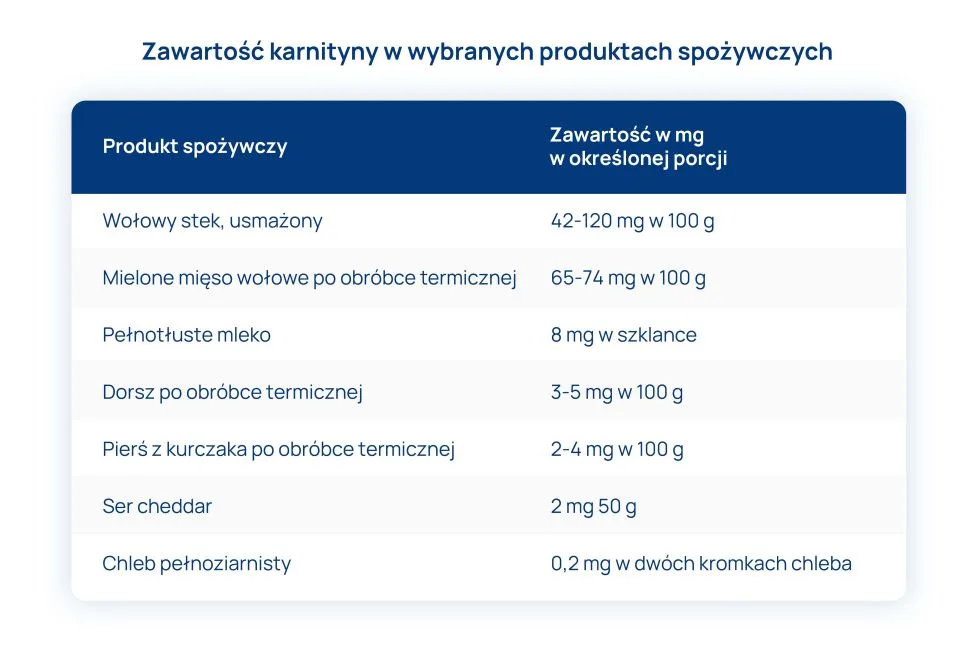
Karnityna wchłania się z diety w ok. 75%. Jest związkiem rozpuszczalnym w wodzie, dlatego każda obróbka termiczna zmniejsza jej zawartość w pokarmach.
Około 95% wchłoniętego związku gromadzi się w mięśniach szkieletowych i w sercu. Tylko 0,5% krąży w osoczu, pozostała ilość zmagazynowana jest w wątrobie i nerkach.
Nadmiar karnityny wydalany jest z moczem.
Nie ustalono referencyjnego spożycia karnityny, ponieważ nie jest ona niezbędnym składnikiem odżywczym, który musi być dostarczany w określonych ilościach. Szacuje się jednak, iż dzienne, sumaryczne (dostarczanej z dietą i syntetyzowane w organizmie) zapotrzebowanie na karnitynę wynosi 15 mg. Dieta osoby jedzącej mięso i produkty mleczne dostarcza od 25 do nawet 150 mg tego związku dziennie. Dieta wegańska natomiast zawiera tylko 1,2 mg karnityny. Nie ma to jednak wpływu na podaż tego związku, ponieważ osoba na takiej diecie syntetyzuje ok. 14,5 mg karnityny, natomiast osoba jedząca każdy rodzaj pokarmów może wytworzyć ok. 35 mg karnityny. Dlatego u zdrowych osób nie obserwuje się niedoborów tego związku, nawet u wegan.
Niedobór karnityny obserwuje się u osób, które mają genetycznie uwarunkowane uszkodzenie funkcji transportera karnityny i objawia się u niemowląt i małych dzieci.

Czy karnityna wspomaga odchudzanie?
Ze względu na fakt, iż karnityna uczestniczy w transporcie kwasów tłuszczowych do wnętrza mitochondriów, gdzie mogą być przekształcane w energię, przez wiele osób jest przyjmowana w postaci suplementu diety, który ma wspomagać redukcję tkanki tłuszczowej i odchudzanie.
Podstawy teoretyczne takiego wnioskowania były słuszne, jednak wykonana w roku 2016 metaanaliza badań poświęconych wpływowi karnityny na ten proces ostudziła nastroje. Wykazano, iż suplementacja karnityną rzeczywiście zmniejszyła masę ciała osób ją zażywających o 1,21 kg, jednak pozostało to bez wpływu na masę tkanki tłuszczowej (nie wykazano jej redukcji) i obwód w talii. Ponadto maksymalny efekt obniżający masę ciała zaobserwowano u osób dorosłych spożywających 2 000 mg karnityny dziennie.
Wniosek z metaanalizy wskazuje, iż przyjmowanie suplementów L-karnityny w sposób nieznaczny wpływa na redukcję masy ciała, natomiast nie ma wpływu na BMI i zawartość tkanki tłuszczowej, zwłaszcza u pacjentów dorosłych z nadwagą lub otyłością.
Piśmiennictwo
- Nałęcz K., Nałęcz M., Karnityna – mitochondria i nie tylko, Postępy Biochemii, tom 62(2)2016.
- Olek R., Suplementacja karnityną – dwie strony medalu, KOSMOS, Problemy Nauk Biologicznych, tom 69 2020, numer 4 (329), strony 777-784.
- Murray R., Biochemia Harpera, Wydawnictwo Lekarskie PZWL, wydanie IV, 1998
- Talenezhad N, Mohammadi M, Ramezani-Jolfaie N, Mozaffari-Khosravi H, Salehi-Abargouei A. Effects of l-carnitine supplementation on weight loss and body composition: A systematic review and meta-analysis of 37 randomized controlled clinical trials with dose-response analysis. Clin Nutr ESPEN. 2020 Jun;37:9-23. doi: 10.1016/j.clnesp.2020.03.008. Epub 2020 Apr 18. PMID: 32359762.
- https://ods.od.nih.gov/factsheets/Carnitine-HealthProfessional/