Wymioty i biegunka to dość częste objawy wśród niemowląt i małych dzieci, które zazwyczaj są kojarzone z zakażeniem przewodu pokarmowego. Także i w tym przypadku pokusa domknięcia poznawczego bywa zwodnicza, gdyż rzadsze przyczyny (i niekiedy bardzo poważne) tego typu dolegliwości, jak sama nazwa wskazuje, są po prostu rzadsze, lecz nie nieobecne. W wychwyceniu groźnego podłoża w pierwszej kolejności pomaga wiedza i wynikająca z niej świadomość istnienia różnych schorzeń. Jednym z nich jest zespół zwany FPIES; co kryje się za tym akronimem?
Spis treści
- Zespół FPIES – definicja i postacie choroby
- Objawy zespołu FPIES
- Kryteria rozpoznania zespołu FPIES
- Skala zachorowań – jak często występuje zespół FPIES?
- Odchylenia laboratoryjne w zespole FPIES
- Zespół FPIES – diagnostyka różnicowa
- Kiedy podejrzewać zespół FPIES u dziecka?
Zespół FPIES – definicja i postacie choroby
Zespół zapalenia jelit wywołanego białkami pokarmowymi (z ang. food protein-induced enterocolitis syndrome, FPIES) to alergia pokarmowa występująca głównie u niemowląt, charakteryzująca się opóźnionymi (zazwyczaj w ciągu kilku godzin od posiłku) objawami z przewodu pokarmowego, głównie wymiotami. Wydane w 2017 roku wytyczne International FPIES Society, w zależności od przyjętego kryterium, wyróżniają kilka postaci choroby. W postaci wczesnej objawy pojawiają się przed 9. miesiącem życia, a w późnej dolegliwości rozpoczynają się powyżej tego wieku. Dodatnie miano swoistych przeciwciał przeciwko danemu składnikowi pokarmowemu upoważnia do rozpoznania postaci IgE-dodatniej, a ich brak do IgE ujemnej. Z klinicznego punktu widzenia zdecydowanie ważniejsza jest klasyfikacja ze względu na czas trwania dolegliwości (postać ostra i późna) oraz ich nasilenie (postać łagodna do umiarkowanej i ciężka).
Objawy zespołu FPIES
W ostrym przebiegu zespołu FPIES dochodzi do wymiotów, które rozpoczynają się zwykle w ciągu 1 do 4 godzin od choćby niewielkiej ekspozycji na pokarm, czemu może towarzyszyć apatia, bladość, a niekiedy także biegunka (w ciągu 24 godzin od początku objawów, zazwyczaj między 5. a 10. godziną). Do ustąpienia objawów, oczywiście po eliminacji alergenu z diety, dochodzi samoistnie w ciągu 24 godzin. W postaci ostrej wzrastanie i rozwój dziecka (a więc najczulsze markery dobrostanu dziecka w tej grupie wiekowej) są prawidłowe, a podczas próby eliminacji mały pacjent nie wykazuje żadnych objawów. Trudniejsza do wychwycenia jest forma przewlekła, w przebiegu której pojawiają się sporadyczne wymioty, przewlekła biegunka, słaby przyrost masy ciała lub spowolnienie rozwoju. Niemowlęta dotknięte tą postacią choroby zwykle wracają do zdrowia w ciągu 3 do 10 dni od przejścia na mieszankę mleczną hipoalergiczną. Nasilenie choroby i związany z tym szereg objawów wtórnych bywa zróżnicowany – postaci łagodne do umiarkowanych skutkują bladością, apatią, a ciężkie także odwodnieniem, hipotensją ze wstrząsem hipowolemicznym włącznie, methemoglobinemią i kwasicą metaboliczną.
Kryteria rozpoznania zespołu FPIES
Podstawą rozpoznania jest dokładna ocena kliniczna. Wspomniane wytyczne ekspertów zrzeszonych w International FPIES Society wyróżniają kryterium duże (wymioty w okresie od 1 do 4 godzin po spożyciu podejrzanego pokarmu i brak klasycznych objawów alergicznych skóry lub dróg oddechowych zależnych od IgE) i kilka małych (drugi lub więcej epizod powtarzających się wymiotów po zjedzeniu tego samego podejrzanego pokarmu; powtarzający się epizod wymiotów 1-4 h po zjedzeniu innego pokarmu; skrajna apatia z jakąkolwiek podejrzaną reakcją; wyraźna bladość z jakąkolwiek podejrzaną reakcją; konieczność wizyty na oddziale ratunkowym; konieczność dożylnego podania płynów; biegunka w ciągu 24 godzin (zwykle 5-10); niedociśnienie; hipotermia). Zespół FPRIES jest rozpoznawany, gdy jest spełnione kryterium duże i co najmniej 3 małe.
Skala zachorowań – jak często występuje zespół FPIES?
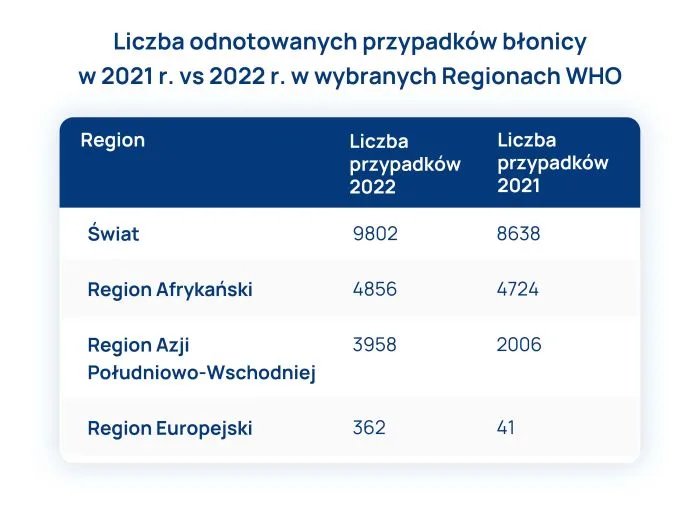
Choroba po raz pierwszy została opisana w latach 70. ubiegłego wieku, a więc około 50 lat temu, mimo to świadomość jej istnienia przez wiele lat była (i nadal jest) niewystarczająca. Z powyższych względów brakuje wiarygodnych danych na temat częstości występowania FPIES, a skąpe dane literaturowe są zróżnicowane, ale pozwalają stwierdzić, że jest to patologia nierzadka, ze skumulowaną częstością występowania od 0,05% do 0,7%. W miarę wzrostu świadomości prawdopodobne jest, że przyszłe badania wykażą wyższe odsetki.
Odchylenia laboratoryjne w zespole FPIES
Oczywistym wydaje się fakt, że w postaci ciężkiej, przebiegającej ze złym stanem ogólnym, próby „spokojnej”, ambulatoryjnej diagnostyki wydają się co najmniej absurdalne. W tego typu przypadkach wymagana jest hospitalizacja, tym bardziej, że nasilone wymioty u niemowlęcia mogą wystąpić na tle różnego podłoża, niekiedy znacznie groźniejszego niż zespół FPIES. W przypadkach łagodnych, które mogą być diagnozowane ambulatoryjnie, najczęstszymi z odchyleń są zwiększona liczba białych krwinek ze zwiększonym odsetkiem neutrofili, zwiększona liczba płytek krwi, a w próbce kału mogą występować leukocyty, eozynofile lub zwiększona zawartość węglowodanów.

Zespół FPIES – diagnostyka różnicowa
W diagnostyce różnicowej należy uwzględnić wiele schorzeń, takich jak np. nietolerancja laktozy, alergia pokarmowa, choroba refluksowa przełyku, a także występujące dość rzadko nieswoiste choroby zapalne jelit, szereg chorób metabolicznych czy celiakię; poniżej skupimy się na łagodnych postaciach FPIES, które, jak wspomniano, można stosunkowo bezpiecznie różnicować ambulatoryjnie.
W przypadku, gdy niemowlę zaczyna prezentować objawy sugerujące FPIES, w pierwszej kolejności należy zasięgnąć pomocy co najmniej lekarza rodzinnego, a optymalnie specjalisty pediatry. Stąd rolą rodziców powinna być uważna obserwacja dziecka pod kątem prezentowanych zachowań, związku objawów z przyjmowanym pokarmem, śledzenie rozwoju i wzrastania (szczegółowa ocena tych elementów jest głównie domeną lekarską). Z uwagi na to, że nie istnieje swoisty dla FPIES marker laboratoryjny, podstawą do zlecenia badań jest dokładnie zebrany wywiad i badanie przedmiotowe, które pozwala na ukierunkowanie diagnostyki w sposób prowadzący do szybkiego rozpoznania. Do najczęściej wykonywanych badań należą morfologia z rozmazem, elektrolity, kreatynina, glukoza, żelazo, ferrytyna, IgE całkowite, a w przypadku cech niedożywienia także białko całkowite, albumina, ALT, AST. Równie ważna jest ocena kału, w ramach której przeprowadzana jest ocena biochemiczna, a oprócz tego oznaczane są biomarkery, spośród których (jako ocena wstępna) najpopularniejszym jest kalprotektyna.

>>> Przeczytaj też: Kalprotektyna w kale – marker stanu zapalnego jelit
Kiedy podejrzewać zespół FPIES u dziecka?
Zespół FPIES należy podejrzewać, gdy niemowlę prezentuje wymioty od 1 do 4 godzin po karmieniu; nasilenie objawów bywa niekiedy ciężkie, stąd konieczna jest uważna obserwacja dziecka, a w przypadku wątpliwości pilne szukanie pomocy lekarskiej. Rozpoznanie zespołu FPIES odbywa się na podstawie oceny klinicznej, jednak w przypadkach wątpliwych dodatkowa ocena laboratoryjna pozwala ustalić przyczynę prezentowanych dolegliwości.
Piśmiennictwo